PRF – новое поколение препаратов плазмы
22.12.2021
15765
Резюмируйте эту статью с искусственным интеллектом
Авторы научной статьи:
Xuzhu Wang DDS, PhD1,2 | Yang Yang DDS, MSc1,2| Yufeng Zhang DDS, PhD1,2 | Ричард Дж. Мирон DDS, PhD3
- The State Key Laboratory Breeding Base of Basic Science Of Stomatology (Hubei-MOST) & Key Laboratory of Oral Biomedicine Ministry of Education, School & Hospital of Stomatology, Wuhan University (Ухань, Китай).
- Department of Oral Implantology, School and Hospital of Stomatology, Wuhan University (Ухань, Китай)
- Department of Periodontology, University of Bern (Берн, Швейцария)
PRP и PRF: история, факты, сравнение
Регенеративная медицина и омолаживающая терапия, стали чуть ли не самыми перспективными направлениями эстетической медицины, благодаря многочисленным исследованиям последнего десятилетия.
Раньше, первые версии тромбоцитарных концентратов получали с использованием антикоагулянтов (PRP). Недавние новые исследования с модификацией времени и скорости центрифугирования, позволили произвести жидкую фракцию обогащенного тромбоцитами фибрина (PRF) и, что самое главное, без использования антикоагулянтов.
Целью создания данного продукта, было сравнение полностью натурального концентрата тромбоцитов (PRF) с уже известным PRP для процесса регенерации клеток кожи.
Для этого, фибробласты кожи культивировали с использованием PRF или PRP, и исследовали их способность стимулировать и влиять на жизнедеятельность, миграцию, пролиферацию клеток и уровень мРНК медиаторов биологических процессов в коже, включая высвобождение PDGF, TGF-бета, фибронектина.
Результаты показали, что все концентраты тромбоцитов были нетоксичными для клеток, что демонстрировало их высокую выживаемость.
В результате две фракции тромбоцитов (PRP и PRF) не показали никакой токсичности. Однако, миграция фибробластов кожи (более чем на 350 %) была больше при использовании PRF по сравнению с контрольной фракцией PRP (увеличилось на 200 %). Индукция клеточной пролиферации через 5 дней была больше с использованием PRF.
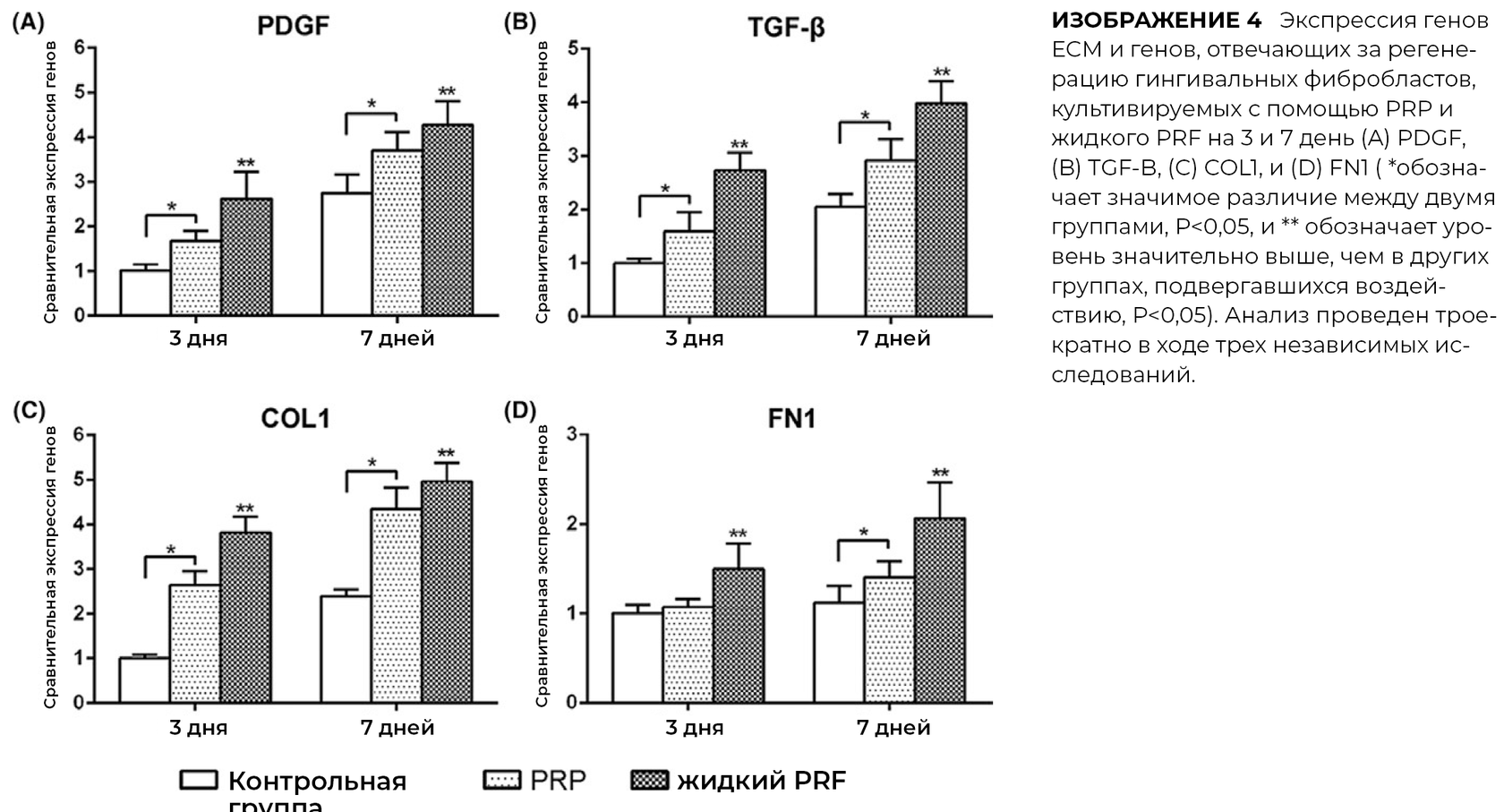
Известно, что и PRF, и PRP стимулировали увеличение уровня синтеза мРНК фактора PDGF. Однако было обнаружено, что все уровни TGF-бета, коллагена 1 типа и фибронектина мРНК были намного выше, чем в группе с использованием PRF.
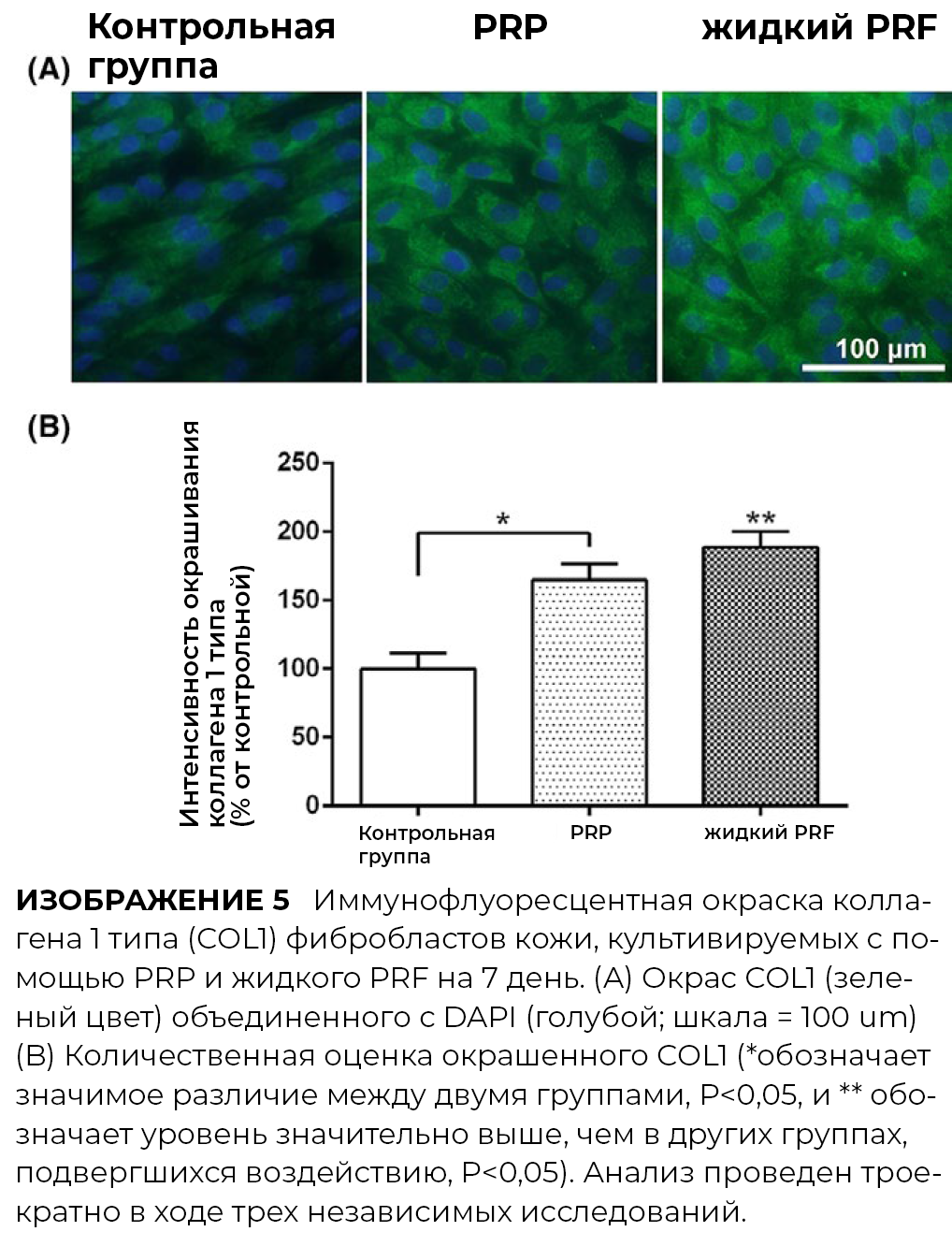
Кроме этого, PRF продемонстрировало значительно большую способность индуцировать синтез матричного коллагена сравнительно со свойствами PRP.
Согласно результатам исследований, PRF демонстрирует лучший регенеративный потенциал для фибробластов кожи человека.
Клинические исследования в омолаживающей эстетике лица с использованием PRF – тромбоцитарных концентратов без антикоагулянтов, доказывают потенциальные преимущества перед PRP.
Фибрин, обогащенный тромбоцитами (PRF) – более сильный стимулятор миграции фибробластов, их пролиферации и синтеза коллагена по сравнению с PRP.
Старение кожи: механизмы и современный подход к омоложению
Старение кожи – неизбежный процесс и результат возрастных изменений.
Он характеризуется понижением регенеративной способности клеток, что в свою очередь приводит к потере тканевой массы, описанной в литературе как “резорбция”.2
С возрастом, общее количество коллагена и эластина в коже тоже уменьшается, при этом происходит их качественная деградация.
Эти процессы приводят к трехмерным изменениям в форме и контуре лица: потеря тонуса кожи, появление морщин, заломов. Сюда относятся и изменения текстуры кожи, ее сухость и ксероз.
Учитывая постоянно растущий спрос на процедуры омоложения лица, регенерация стареющих тканей будет оставаться приоритетом, тем более что постоянно развиваются новые технологии и средства коррекции процессов старения.
Одна из таких технологий – аутологическая мезотерапия плазмой крови.
Обогащенная тромбоцитами плазма (PRP) регулярно используется в течение последних двух десятилетий, как эффективное дополнение к различным медицинским процедурам, в частности регенеративным.
Обогащенная тромбоцитами плазма (PRP) получила широкое применение благодаря своей способности активизировать цитокины и факторы роста. Свои свойства плазма приобретает в результате центрифугирования и, как правило, с использованием антикоагулянтов. PRP технология успешно применяется во многих областях медицины.
Области применения PRP-терапии:
- лечение ран;
- травмы мягких тканей;
- челюстно-лицевая хирургия;
- оральная и пародонтологическая хирургия;
- ортопедия;
- желудочно-кишечная хирургия;
- комбустиология;
- эстетическая и регенеративная медицина.
В последние годы, PRP используется в лечебных протоколах широкого спектра дерматологических проблем, включая комплексную терапию рубцов, акне, постакне, заживление ран на лице, для пролонгирования результатов липофилинга, алопеции, улучшение качества кожи и ее омоложение.6,8
Из α-гранул тромбоцитов, после активации индукторами агрегации, выделяется большое количество факторов роста, включая TGF, PDGF, VEGF, IGF-1, EGF и FGF.
Многие из них влияют на фибробласты, стимулируя процесс синтеза коллагена.
Несмотря на многочисленные показания к использованию и преимущества самой технологии PRP, не решен вопрос с антикоагулянтами. Как известно, антикоагулянты, при добавлении в плазму, ингибируют ее регенеративные свойства.11,12
Что такое PRF?
Фибрин, обогащенный тромбоцитами (PRF) – это концентрат, состоящий из собственно тромбоцитов плазмы крови и факторов роста. Особенностью и уникальностью технологии является то, что для получения PRF антикоагулянты не используются.13, 14
PRF можно получить упрощенным методом всего за один цикл центрифугирования.
PRF, при введении в ткани, образует фибриновую сетку, содержащую в своей структуре многочисленные факторы роста. Благодаря этому, во время процесса регенерации тканей, имеющиеся в PRF факторы роста и цитокины, высвобождаются не сразу, а постепенно, обеспечивая пролонгированную, правильную регенерацию тканей.13, 14
Таким образом, PRF не только поддерживает гемостаз и физиологический процесс заживления ран, но и способствует его ускорению.
За последнее десятилетие PRF получил широкое применение в стоматологических и других медицинских процедурах.
В эстетической медицине PRF используется для лечения дефектов мягких тканей и травм лица, глубоких носогубных складок, поверхностных морщин, в сочетании с хирургическими процедурами, липофилингом, в терапии рубцов, акне, постакне.
Процедура с PRF включает более быстрый процесс ангионеогенеза – реваскуляризацию пораженной зоны, заживление ран и полную иммунную биосовместимость.15
Разница между PRP и PRF
Одной из проблем в применении PRF, в отличие от PRP было то, что PRF имеет вязкую консистенцию.
Встал вопрос получения жидкого по консистенции PRF, содержащего фибриноген и тромбин до превращения его в твердый фибрин.13
Флюид PRF остается жидким в течение 15 минут, при этом антикоагулянты не используются.
Благодаря его свойству, он может быть использован как инъекционный материал. А после инъекции в кожу быстро сворачивается с образованием фибрина.
Эти свойства делают PRP идеальным для целого ряда медицинских целей, например в области эстетики лица, его используют для реваскуляризации тканей, как минимально инвазивный, биосовместимый, 100% натуральный инъекционный материал.
Целью доклинического исследования, было изучение регенерационного потенциала PRF, по сравнению со стандартным PRP.
Оценивалась способность фибробластов кожи к пролиферации, содействие миграции клеток, уровень клеточной мРНК известных медиаторов и синтез коллагена in vitro.
2. Материалы и методы
2.1 Приготовление PRP и флюида-PRF
PRP готовили традиционным способом с использованием антикоагулянтов.16
Сначала PRP и бедную тромбоцитами плазму (PPP) отделяли от фракции эритроцитов (RBC), путем центрифугирования 10 мл цельной крови с антикоагулянтом (EDTA) при 900 g в течение 5 мин., а затем PRP отделяли от PPP, путем центрифугирования вторично, при 2000 g в течение 15 минут. Наконец, было собрано около 1 мл PRP.
PRF получали с использованием 10 мл цельной крови без антикоагулянта, и центрифугирование проводили при 60 g в течение 3 минут. Верхний слой, состоявший примерно из 1 мл плазмы, был обозначен как флюид (жидкий) PRF. Затем мы перенесли PRP и флюид-PRF в посуду из шести лунок и добавили 5 мл DMEM/HyClone/Thermo Fisher Scientific Inc.
2.2 Выделение кожных фибробластов человека
У трех доноров, проходивших регенеративное лечение по поводу «заячьей губы», были взяты образцы кожи лица.
Клетки фибробластов получали из кожи над верхней губой. Собранные образцы трижды промывали фосфатно - солевым раствором (PBS; 150 мМ NaCl, 20 мМ фосфата натрия, рН 7,2), содержавшим 1% антибиотиков (100 ЕД/мл пенициллина G, 100 мкг/мл стрептом) и был фракционирован на небольшие лоскуты с помощью стерильных хирургических ножниц. Затем лоскуты кожной ткани, в колбах для культивирования T25 из DMEM, содержащие 20% фетальной бычьей сыворотки (FBS; Gibco, Life Technologies Corporation) из 1% антибиотиков поместили в инкубатор при 37°C при 5% CO2.
На 7-й день обнаружены новые клетки вокруг лоскутов кожи. После слияния новообразовавшихся клеток, фибробласты кожи трипсинизировали и далее культивировали в DMEM с 10% FBS.
2.3 Жизнеспособность клеток
Через 24 часа после посева, клетки фибробластов кожи человека, были окрашены 2 мкмоль/л мембранопроницаемым красителем - кальцеином АМ (Доджиндо) и 4 мкмоль/л пропидия йодида (ПИ, Сигма) в течение 15 минут при 37 °С. Живые клетки окрашивали в зеленый, а мертвые клетки – красным с PI. Флуоресцентные изображения были сделаны с помощью люминесцентного микроскопа Olympus DP71 (Olympus Co.). После этого высчитывался процент живых клеток по сравнению с мертвыми из PRP и PRF.
2.4 Клеточная морфология
Для изучения морфологии клеток фибробласты кожи человека высевали плотностью 10 000 клеток с/без добавления PRP или PRF-флюида (концентрация 20%) в 24-луночные планшеты. Через 2, 4, 8 и 24 часа клетки фиксировали 4% формальдегидом с последующей промывкой PBS в течение 5 минут. Затем клетки окрашивали 5 мкг/мл фаллоидином - FITC (зеленая флуоресценция, Sigma - Aldrich) в течение 1 часа в темных условиях при 37°C.16 Ядра окрашивали DAPI (синяя флуоресценция).
Флуоресцентные изображения были сняты с помощью микроскопа флуоресцентного Olympus DP71 (Olympus Co) и сравнили их по морфологическим различиям.
Анализ клетки проводили посредством программы ImageJ.
Эксперимент проводили в трех экземплярах с тремя независимыми экспертами.
ПЦР – анализ в режиме реального времени
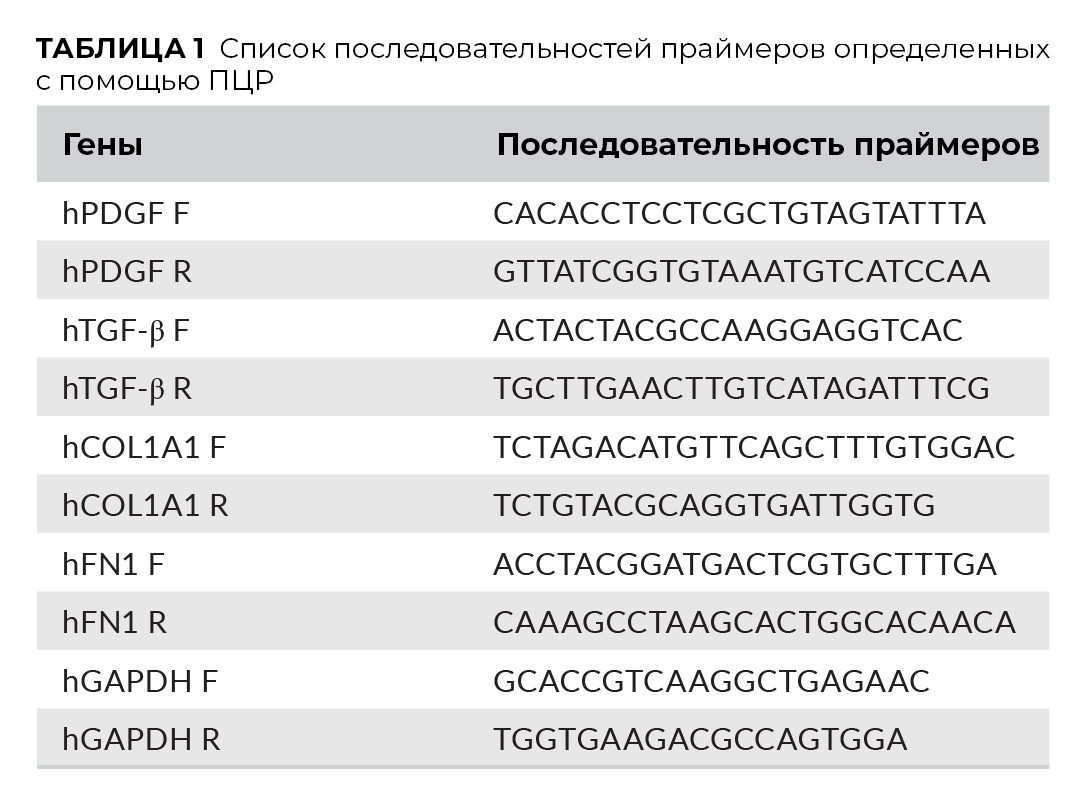
Для исследования экспрессии генов, связанных с регенерацией, были определены тромбоцитарный фактор роста (PDGF), трансформирующий фактор роста – бета (TGF-β), коллаген типа I alpha1 (COL1a1) и фибронектин (FN1). Анализ проводился методом ПЦР в реальном времени.
Фибробласты кожи человека культивировали с/без PRP или флюид-PRF (концентрация 20%) в 24-луночном планшете при плотности 50 000 клеток на лунку. Через 3 и 7 дней культивирования, общая РНК была экстрагирована из клеток с помощью AxyPrepTM Multisource Total RNA Miniprep Kit (AXYGEN) согласно протоколу производителя. Концентрацию РНК определяли посредством спектрофотометра NanoDrop 2000 UV-Vis
Окрашивание коллагена I типа
Фибробласты человеческой кожи культивировали в 24-луночном планшете, при плотности 50 000 клеток на лунку в течение 7 дней. Клетки промывали PBS и фиксировали 4% формальдегидом в течение 10 минут. Затем их инкубировали в течение 1 часа до коллагена типа I (1: 100, Booster Biological Technology Ltd), разведенного в PBS, содержавшего 2% бычьего сывороточного альбумина (BSA) с последующей инкубацией с козьим антибиотиком FITC (1: 200, Invitrogen).
Наконец, ядра окрашивали с помощью DAPI (синяя флуоресценция). После каждого этапа клетки промывали трижды PBS.
Изображения были сделаны флуоресцентным микроскопом Olympus DP71 (Olympus Co.). Количественный анализ интенсивности окрашивания проводили с помощью ImageJ программного обеспечения.
Статистический анализ
Статистический анализ проводили с помощью односторонней ANOVA с тестом Бонферрони посредством программного обеспечения GraphPad v. 6, и статистическая значимость рассматривалась при Р<0,05. Все данные выражены как среднее значение ±SE.
3. РЕЗУЛЬТАТЫ
3.1 Жизнеспособность клеток
При изучении влияния PRF и PRP на жизнеспособность кожных клеток кожи установлено, что через 24 часа > 95% клеток оставались жизнеспособными, при этом не наблюдалось значительных отличий между группами. И PRP, и PRF не проявляли токсичности в отношении выживаемости клеток.
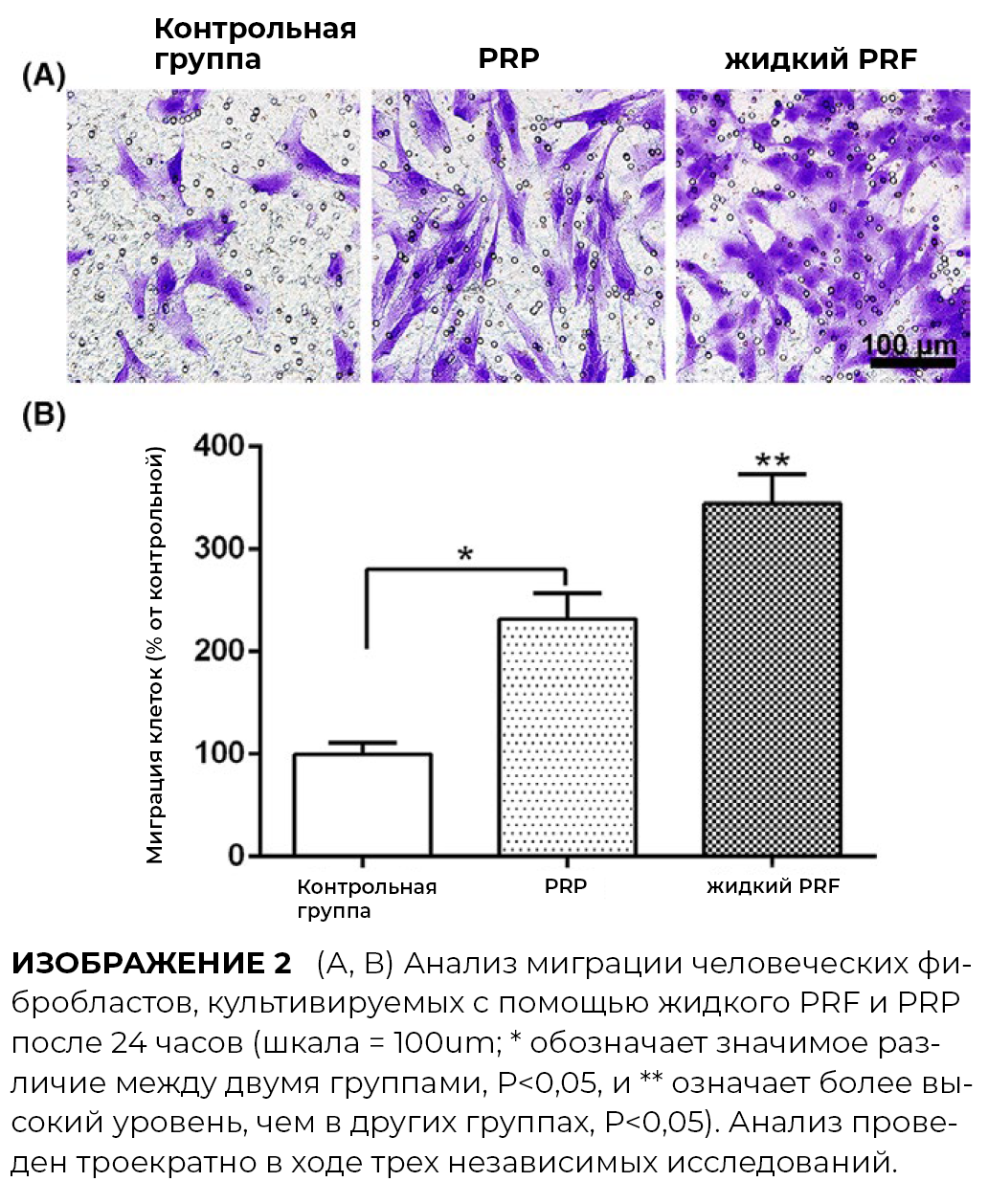
3.2 Миграция клеток
Поскольку количество и миграция фибробластов кожи человека играют важную роль в ранней фазе заживления ран, влияние PRF и PRP исследовали посредством анализа трансвелл. И PRP, и PRF стимулировали миграцию фибробластов кожи человека спустя 24 часа. Стимуляция миграции клеток PRP была на 200% больше по сравнению с контрольной группой, тогда как показатели PRF составляли на 300% увеличение миграции по сравнению с контрольной группой.
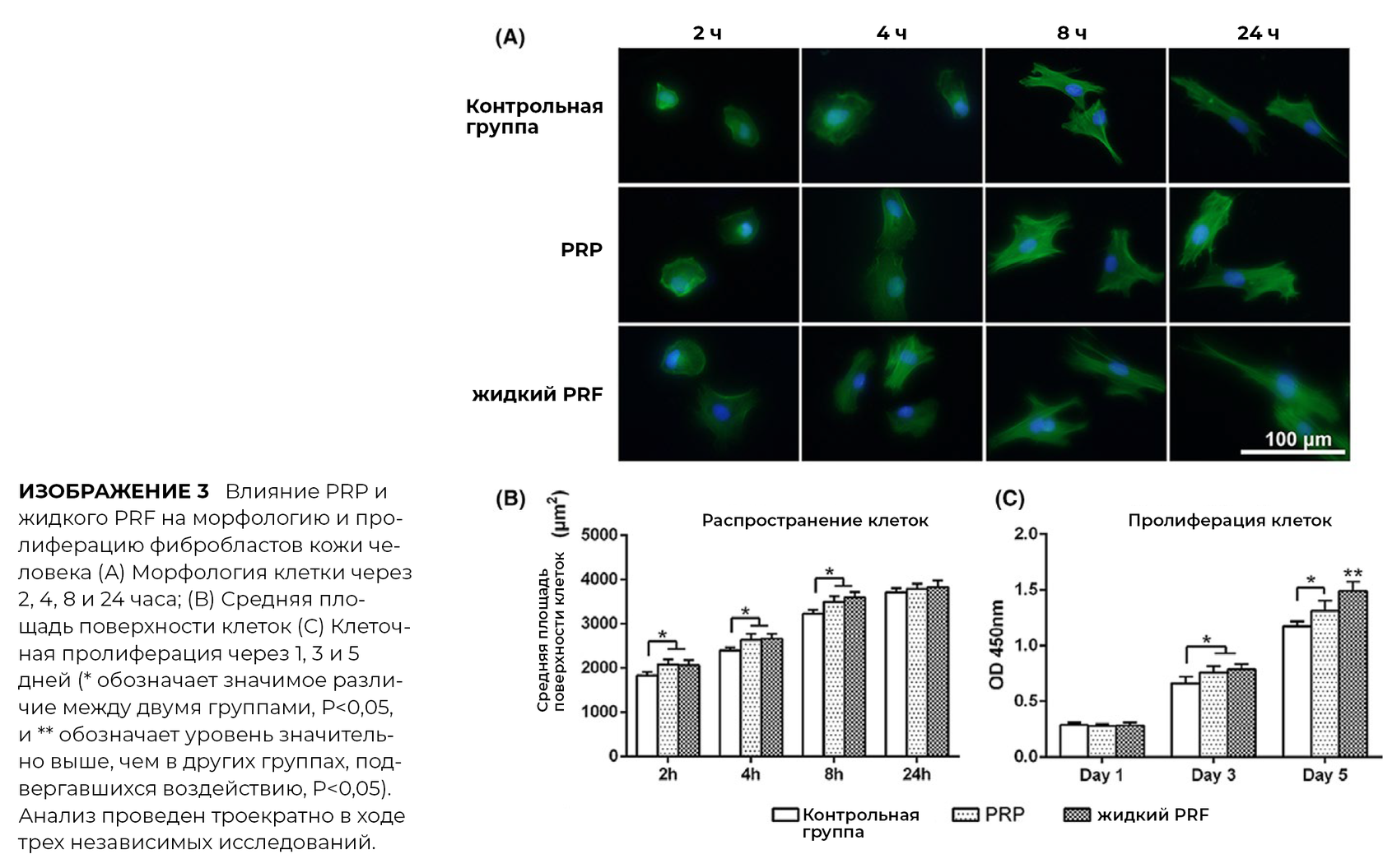
3.3 Клеточная морфология и пролиферация
Фибробласты человеческой кожи исследовали на морфологические различия с/без применения PRP и PRF через 2, 4, 8 и 24 часа после посева.
PRP и PRF значительно увеличивают клеточную пролиферацию фибробластов кожи человека на 3 и 5 день после посева. Однако PRF, далее, показал значительно большую пролиферацию клеток через 5 дней.

3.4 Экспрессия генов, связанных с регенерацией фибробластов кожи человека и ECM
Влияние PRP и PRF на экспрессию генов, связанных с регенерацией, включая факторы роста TGF-β и PDGF, оценивали с помощью ПЦР в реальном времени.
PRP и PRF индуцировали увеличение экспрессии PDGF и TGF-β на 3 и 7 день, при этом PRF демонстрировал значительно более высокие уровни мРНК PDGF через 3 дня, и уровень мРНК TGF-β на 3 и 7 день после посева. PRF значительно повысил уровень мРНК COL1 на 3 и 7 день. И PRP, и PRF в значительной степени индуцировали экспрессию мРНК FN1, при этом PRF продемонстрировал значительно более высокие показатели по сравнению со всеми другими группами.
3.5 Окрашивание коллагена I типа
Для оценки влияния PRP и PRF на синтез коллагена фибробластами кожи человека, было произведено иммунофлуоресцентное окрашивание коллагена 1 типа. PRP показал незначительное увеличение внутриклеточного окрашивания коллагена типа 1, тогда как PRF индуцировал примерно двухкратное увеличение коллагена 1 типа среди трех групп.
4. ОБСУЖДЕНИЕ
В этом исследовании регенеративный потенциал PRF изучали по активности фибробластов кожи, по сравнению со стандартным PRP. Это первое регенеративное исследование на сегодняшний день, исследующее использование PRF в области эстетики лица в доклинической модели и клинических условиях.
Целью было сначала проверить и охарактеризовать регенеративный потенциал PRF in vitro на кожных фибробластах по сравнению с PRP.
Одним из основных преимуществ использования PRF в различных отраслях регенеративной медицины, является ее низкая стоимость по сравнению с другими регенеративными методами, или рекомбинантными факторами роста/гормонами, центрифугирование.
Центрифугирование проводили в течение 12 минут при 2700 об/мин (сила примерно 700g при RCF - max)18. Центрифугирование на большей скорости приводят к полной потере лейкоцитов и других факторов роста.
По этой причине недавно было предложено использовать меньшие скорости центрифугирования для увеличения количества лейкоцитов и факторов роста, содержащихся в PRF.19,20 Данную жидкую фракцию PRF можно использовать примерно в течение 15 минут. Благодаря этому его применяют как инъекционный препарат в различных областях медицины, например в стоматологической медицине, в частности в сочетании с разными биоматериалами, в ортопедических инъекциях при остеоартрите колена, а совсем недавно и в эстетике лица.
Это исследование показало влияние PRP или PRF на поведение фибробластов в культуре клеток кожи.
Выявлено, что PRF способен значительно увеличивать миграцию фибробластов по сравнению с PRP.
В клиническом контексте это означает, что применение в эстетике лица методики PRF обеспечивает образование большего количества новых клеток и высокие уровни их пролиферации по сравнению с применением PRP.
При сравнении количества мРНК факторов роста и белков внеклеточного матрикса, с помощью ПЦР обнаружено, что PRF повышает уровень мРНК ассоциированных генов. Интересен также тот факт, что PRF содержит более высокие уровни факторов роста по сравнению с PRP.
Исследование показало, что меньшие скорости центрифугирования дают большее количество лейкоцитов в PRF.13,14 однако специфическая роль лейкоцитов во время регенерации тканей и восстановления ран пока не вполне ясна. Интересно, что преимуществом лейкоцитов есть то, что они являются иммунными клетками, ответственными за защиту организма и устойчивость к патогенам во время процесса заживления.
Они также выделяют широкий спектр факторов роста, связанных с регенерацией тканей.
И самое главное: три отдельных исследования трех независимых групп недавно показали, что при добавлении лейкоцитов к стандартным препаратам PRP (PRP обычно содержит низкие концентрации лейкоцитов), заживление ран было значительно улучшено.23-25
Несмотря на то, что их роль остается не совсем ясной, исследования показывают, что лейкоциты играют чрезвычайно важную роль во время заживления ран.
Хотя это исследование остается доклиническим, данные показывают, что PRF поддерживает миграцию и пролиферацию фибробластов кожи, увеличивает уровень клеточной мРНК мощных регенеративных факторов роста и молекул внеклеточного матрикса, а также улучшает синтез коллагена.
Список литературы:
- Zhou, Y.; Fu, B.; Zheng, X.; Wang, D.; Zhao, C.; Qi, Y.; Sun, R.; Tian, Z.; Xu, X.; Wei, H. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl. Sci. Rev. 2020, 7, 998–1002. [CrossRef]
- Xu, Y.; Baylink, D.J.; Chen, C.S.; Reeves, M.E.; Xiao, J.; Lacy, C.; Lau, E.; Cao, H. The importance of vitamin d metabolism as a potential prophylactic, immunoregulatory and neuroprotective treatment for COVID-19. J. Transl. Med. 2020, 18, 322. [CrossRef] [PubMed]
- Ali, A.M.; Kunugi, H. Approaches to nutritional screening in patients with Coronavirus Disease 2019 (COVID-19). Int. J. Environ. Res. Public Health 2021, 18, 2772. [CrossRef] [PubMed]
- Wang, W.; Xu, Y.; Gao, R.; Lu, R.; Han, K.; Wu, G.; Tan, W. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA 2020, 323, 1843–1844. [CrossRef]
- Tavazzi, G.; Pellegrini, C.; Maurelli, M.; Belliato, M.; Sciutti, F.; Bottazzi, A.; Sepe, P.A.; Resasco, T.; Camporotondo, R.; Bruno, R.; et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur. J. Heart Fail. 2020, 22, 911–915. [CrossRef]
- Riuzzi, F.; Sorci, G.; Sagheddu, R.; Chiappalupi, S.; Salvadori, L.; Donato, R. RAGE in the pathophysiology of skeletal muscle. J. Cachexia Sarcopenia Muscle 2018, 9, 1213–1234. [CrossRef]
- Egawa, T.; Ohno, Y.; Yokoyama, S.; Yokokawa, T.; Tsuda, S.; Goto, K.; Hayashi, T. The Protective Effect of Brazilian Propolis against Glycation Stress in Mouse Skeletal Muscle. Foods 2019, 8, 439. [CrossRef]
- Nasiri, M.J.; Haddadi, S.; Tahvildari, A.; Farsi, Y.; Arbabi, M.; Hasanzadeh, S.; Jamshidi, P.; Murthi, M.; Mirsaeidi, M. COVID-19 clinical characteristics, and sex-specific risk of mortality: Systematic Review and Meta-analysis. Front. Med. 2020, 7, 459. [CrossRef]
- Zhu, J.; Ji, P.; Pang, J.; Zhong, Z.; Li, H.; He, C.; Zhang, J.; Zhao, C. Clinical characteristics of 3062 COVID-19 patients: A meta-analysis. J. Med. Virol. 2020. [CrossRef]
- Vacchiano, V.; Riguzzi, P.; Volpi, L.; Tappatà, M.; Avoni, P.; Rizzo, G.; Guerra, L.; Zaccaroni, S.; Cortelli, P.; Michelucci, R.; et al. Early neurological manifestations of hospitalized COVID-19 patients. Neurol. Sci. 2020, 41, 2029–2031. [CrossRef]
- Nidadavolu, L.; Walston, J. Underlying Vulnerabilities to the Cytokine Storm and Adverse COVID-19 Outcomes in the Aging Immune System. J. Gerontol. A Biol. Sci. Med. Sci. 2020. [CrossRef]
- Paliwal, V.K.; Garg, R.K.; Gupta, A.; Tejan, N. Neuromuscular presentations in patients with COVID-19. Neurol. Sci. 2020, 41, 3039–3056. [CrossRef] [PubMed]
- Finsterer, J.; Scorza, F. SARS-CoV-2 associated rhabdomyolysis in 32 patients. Turk. J. Med. Sci. 2021. [CrossRef]
- Zhang, X.; Cai, H.; Hu, J.; Lian, J.; Gu, J.; Zhang, S.; Ye, C.; Lu, Y.; Jin, C.; Yu, G.; et al. Epidemiological, clinical characteristics of cases of SARS-CoV-2 infection with abnormal imaging findings. Int. J. Infect. Dis. 2020, 94, 81–87. [CrossRef]
- Welch, C.; Greig, C.; Masud, T.; Wilson, D.; Jackson, T.A. COVID-19 and Acute Sarcopenia. Aging Dis. 2020, 11, 1345–1351.
- Pitscheider, L.; Karolyi, M.; Burkert, F.R.; Helbok, R.; Wanschitz, J.V.; Horlings, C.; Pawelka, E.; Omid, S.; Traugott, M.;Seitz, T.; et al. Muscle involvement in SARS-CoV-2 infection. Eur. J. Neurol. 2020. [CrossRef]
- Jin, M.; Tong, Q. Rhabdomyolysis as Potential Late Complication Associated with COVID-19. Emerg. Infect. Dis. 2020, 26, 1618–1620. [CrossRef]
- Breucker, S.D.; Luce, S.; Njemini, R.; Bautmans, I.; Decoster, L.; Mets, T.; Pepersack, T. Analysis of inflammatory markers and hormones in old cancer patients: A descriptive study. Exp. Gerontol. 2020, 130. [CrossRef]
- Zhou, L.; Liu, C.; Yang, C. Comment on ‘COVID-19: A major cause of cachexia and sarcopenia’ by Morley et al. J. Cachexia Sarcopenia Muscle 2021, 12, 233–234. [CrossRef]
- Rosato, C.; Bolondi, G.; Russo, E.; Oliva, A.; Scognamiglio, G.; Mambelli, E.; Longoni, M.; Rossi, G.; Agnoletti, V. Clinical, electromyographical, histopathological characteristics of COVID-19 related rhabdomyolysis. SAGE Open Med. Case Rep. 2020, 25, 2050313X20983132. [CrossRef]
- Zhan, T.; Liu, M.; Tang, Y.; Han, Z.; Cheng, X.; Deng, J.; Chen, X.; Tian, X.; Huang, X. Retrospective analysis of clinical characteristics of 405 patients with COVID-19. J. Int. Med. Res. 2020, 48, 300060520949039. [CrossRef]
- Cheng, A.; Hu, L.; Wang, Y.; Huang, L.; Zhao, L.; Zhang, C.; Liu, X.; Xu, R.; Liu, F.; Li, J.; et al. Diagnostic performance of initial blood urea nitrogen combined with D-dimer levels for predicting in-hospital mortality in COVID-19 patients. Int. J. Antimicrob. Agents 2020, 56, 106110. [CrossRef]
- Liu, G.; Zhang, S.; Mao, Z.; Wang, W.; Hu, H. Clinical significance of nutritional risk screening for older adult patients with COVID-19. Eur. J. Clin. Nutr. 2020, 74, 876–883. [CrossRef]
- Garrigues, E.; Janvier, P.; Kherabi, Y.; Le Bot, A.; Hamon, A.; Gouze, H.; Doucet, L.; Berkani, S.; Oliosi, E.; Mallart, E.; et al. Post-discharge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J. Infect. 2020, 81, e4–e6. [CrossRef]
- Zhong, H.; Wang, Y.; Zhang, Z.L.; Liu, Y.X.; Le, K.J.; Cui, M.; Yu, Y.T.; Gu, Z.C.; Gao, Y.; Lin, H.W. Efficacy and safety of current therapeutic options for COVID-19—Lessons to be learnt from SARS and MERS epidemic: A systematic review and meta-analysis. Pharmacol. Res. 2020, 157, 104872. [CrossRef]
- Du, X.; Liu, Y.; Chen, J.; Peng, L.; Jin, Y.; Cheng, Z.; Wang, H.H.X.; Luo, M.; Chen, L.; Zhao, Y. Comparison of the Clinical Implications among Two Different Nutritional Indices in Hospitalized Patients with COVID-19. medRxiv 2020. [CrossRef]
- Haraj, N.E.; El Aziz, S.; Chadli, A.; Dafir, A.; Mjabber, A.; Aissaoui, O.; Barrou, L.; El Kettani El Hamidi, C.; Nsiri, A.; Al
- Di Filippo, L.; De Lorenzo, R.; D’Amico, M.; Sofia, V.; Roveri, L.; Mele, R.; Saibene, A.; Rovere-Querini, P.; Conte, C. COVID-19 is associated with clinically significant weight loss and risk of malnutrition, independent of hospitalisation: A post-hoc analysis of a prospective cohort study. Clin. Nutr. 2020. [CrossRef]
- Gualtieri, P.; Falcone, C.; Romano, L.; Macheda, S.; Correale, P.; Arciello, P.; Polimeni, N.; Lorenzo, A. Body Composition Findings by Computed Tomography in SARS-CoV-2 Patients: Increased Risk of Muscle Wasting in Obesity. Int. J. Mol. Sci. 2020, 21, 4670. [CrossRef]
- Zeppa, S.D.; Agostini, D.; Piccoli, G.; Stocchi, V.; Sestili, P. Gut Microbiota Status in COVID-19: An Unrecognized Player? Front. Cell Infect. Microbiol. 2020. [CrossRef]
- Zhao, X.; Li, Y.; Ge, Y.; Shi, Y.; Lv, P.; Zhang, J.; Fu, G.; Zhou, Y.; Jiang, K.; Lin, N.; et al. Evaluation of Nutrition Risk and Its Association with Mortality Risk in Severely and Critically Ill COVID-19 Patients. J. Parenter. Enter. Nutr. 2020, 45, 32–42. [CrossRef] [PubMed]
- Witteveen, E.; Wieske, L.; van der Poll, T.; van der Schaaf, M.; van Schaik, I.N.; Schultz, M.J.; Verhamme, C.; Horn, J. Increased Early Systemic Inflammation in ICU-Acquired Weakness; A Prospective Observational Cohort Study. Crit. Care Med. 2017, 45, 972–979. [CrossRef] [PubMed]
- De Lorenzo, R.; Conte, C.; Lanzani, C.; Benedetti, F.; Roveri, L.; Mazza, M.G.; Brioni, E.; Giacalone, G.; Canti, V.; Sofia, V.; et al. Residual clinical damage after COVID-19: A retrospective and prospective observational cohort study. PLoS ONE 2020, 15, e0239570. [CrossRef] [PubMed]
- Alrubaye, R.; Choudhury, H. Severe Rhabdomyolysis in a 35-Year-old Woman with COVID-19 due to SARS-CoV-2 Infection: A Case Report. Am. J. Case Rep. 2020, 21, e926733. [CrossRef]
- Mukherjee, A.; Ghosh, R.; Aftab, G. Rhabdomyolysis in a Patient with Coronavirus Disease 2019. Cureus 2020, 12, e8956. [CrossRef] [PubMed]
- Disser, N.P.; De Micheli, A.J.; Schonk, M.M.; Konnaris, M.A.; Piacentini, A.N.; Edon, D.L.; Toresdahl, B.G.; Rodeo, S.A.; Casey, E.K.; Mendias, C.L. Musculoskeletal Consequences of COVID-19. J. Bone Jt. Surg. Am. 2020, 102, 1197–1204. [CrossRef] [PubMed]
- Ufuk, F.; Demirci, M.; Sagtas, E.; Akbudak, I.H.; Ugurlu, E.; Sari, T. The prognostic value of pneumonia severity score and pectoralis muscle Area on chest CT in adult COVID-19 patients. Eur. J. Radiol. 2020, 131, 109271. [CrossRef]
- Paneroni, M.; Simonelli, C.; Saleri, M.; Bertacchini, L.; Venturelli, M.; Troosters, T.; Ambrosino, N.; Vitacca, M. Muscle Strength and Physical Performance in Patients Without Previous Disabilities Recovering From COVID-19 Pneumonia. Am. J. Phys. Med.Rehabil. 2021, 100, 105–109. [CrossRef]
- Raman, B.; Cassar, M.P.; Tunnicliffe, E.M.; Filippini, N.; Griffanti, L.; Alfaro-Almagro, F.; Okell, T.; Sheerin, F.; Xie, C.; Mah-mod, M.; et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exercise capacity, cognition, quality of life and mental health, post-hospital discharge. EClinicalMedicine 2021, 31, 100683. [CrossRef]
- Li, T.; Zhang, Y.; Gong, C.; Wang, J.; Liu, B.; Shi, L.; Duan, J. Prevalence of malnutrition and analysis of related factors in elderly patients with COVID-19 in Wuhan, China. Eur. J. Clin. Nutr. 2020, 74, 871–875. [CrossRef]
- Reiss, J.; Iglseder, B.; Kreutzer, M.; Weilbuchner, I.; Treschnitzer, W.; Kässmann, H.; Pirich, C.; Reiter, R. Case finding for sarcopenia in geriatric inpatients: Performance of bioimpedance analysis in comparison to dual X-ray absorptiometry. BMC Geriatr. 2016, 16, 52. [CrossRef]
- Tosato, M.; Marzetti, E.; Cesari, M.; Savera, G.; Miller, R.R.; Bernabei, R.; Landi, F.; Calvani, R. Measurement of muscle mass in sarcopenia: From imaging to biochemical markers. Aging Clin. Exp. Res. 2017, 29, 19–27. [CrossRef]
- He, Y.C.; Chen, F. Rhabdomyolysis as Potential Late Complication Associated with COVID-19. Emerg. Infect. Dis. 2020, 26, 2297–2298. [CrossRef]
- Li, J.-W.; Han, T.-W.; Woodward, M.; Anderson, C.S.; Zhou, H.; Chen, Y.-D.; Neal, B. The impact of 2019 novel coronavirus on heart injury: A Systematic review and Meta-analysis. Prog. Cardiovasc. Dis. 2020, 63, 518–524. [CrossRef]
- Bansal, A.; Kumar, A.; Patel, D.; Puri, R.; Kalra, A.; Kapadia, S.R.; Reed, G.W. Meta-analysis Comparing Outcomes in Patients with and Without Cardiac Injury and Coronavirus Disease 2019 (COVID 19). Am. J. Cardiol. 2020. [CrossRef]
- Wu, T.; Zuo, Z.; Kang, S.; Jiang, L.; Luo, X.; Xia, Z.; Liu, J.; Xiao, X.; Ye, M.; Deng, M. Multi-organ Dysfunction in Patients with COVID-19: A Systematic Review and Meta-analysis. Aging Dis. 2020, 11, 874–894. [CrossRef]
- Lau, H.M.; Lee, E.W.; Wong, C.N.; Ng, G.Y.; Jones, A.Y.; Hui, D.S. The impact of severe acute respiratory syndrome on the physical profile and quality of life. Arch. Phys. Med. Rehabil. 2005, 86, 1134–1140. [CrossRef]
- Gkekas, N.K.; Anagnostis, P.; Paraschou, V.; Stamiris, D.; Dellis, S.; Kenanidis, E.; Potoupnis, M.; Tsiridis, E.; Goulis, D.G. The effect of vitamin D plus protein supplementation on sarcopenia: A systematic review and meta-analysis of randomized controlled trials. Maturitas 2021, 145, 56–63. [CrossRef]
- Liao, C.D.; Chen, H.C.; Huang, S.W.; Liou, T.H. The Role of Muscle Mass Gain Following Protein Supplementation Plus Exercise Therapy in Older Adults with Sarcopenia and Frailty Risks: A Systematic Review and Meta-Regression Analysis of Randomized Trials. Nutrients 2019, 11, 1713. [CrossRef]
- Chapple, L.-a.S.; Fetterplace, K.; Asrani, V.; Burrell, A.; Cheng, A.C.; Collins, P.; Doola, R.e.; Ferrie, S.; Marshall, A.P.; Ridley, E.J. Nutrition management for critically and acutely unwell hospitalised patients with coronavirus disease 2019 (COVID-19) in Australia and New Zealand. Nutr. Diet. 2020, 77, 426–436. [CrossRef]
- Cawood, A.L.; Walters, E.R.; Smith, T.R.; Sipaul, R.H.; Stratton, R.J. A Review of Nutrition Support Guidelines for Individuals with or Recovering from COVID-19 in the Community. Nutrients 2020, 12, 3230. [CrossRef] [PubMed]
- Yao, Y.; Luo, Z.; Zhang, X. In silico evaluation of marine fish proteins as nutritional supplements for COVID-19 patients. Food Funct. 2020, 11, 5565–5572. [CrossRef] [PubMed]
- Cengiz,M.;BorkuUysal,B.;Ikitimur,H.;Ozcan,E.;Islamog ̆lu,M.S.;Aktepe,E.;Yavuzer,H.;Yavuzer,S.Effectoforall-Glutamine supplementation on Covid-19 treatment. Clin. Nutr. Exp. 2020, 33, 24–31. [CrossRef] [PubMed]
- Burgess, L.C.; Venugopalan, L.; Badger, J.; Street, T.; Alon, G.; Jarvis, J.C.; Wainwright, T.W.; Everington, T.; Taylor, P.; Swain, I.D. Effect of neuromuscular electrical stimulation on the recovery of people with COVID-19 admitted to the intensive care unit: A narrative review. J. Rehabil. Med. 2021. [CrossRef] [PubMed]
- Liu, K.; Zhang, W.; Yang, Y.; Zhang, J.; Li, Y.; Chend, Y. Respiratory rehabilitation in elderly patients with COVID-19: A randomized controlled study. Complement Ther. Clin. Pract. 2020, 39, 101166. [CrossRef]
- Chaabene, H.; Prieske, O.; Herz, M.; Moran, J.; Höhne, J.; Kliegl, R.; Ramirez-Campillo, R.; Behm, D.G.; Hortobágyi, T.; Granacher, U. Home-based exercise programmes improve physical fitness of healthy older adults: A PRISMA-compliant systematic review and meta-analysis with relevance for COVID-19. Ageing Res. Rev. 2021, 67, 101265. [CrossRef]
Эта статья была полезной?