PRF – нове покоління препаратів плазми
Автори наукової статті:
Xuzhu Wang DDS, PhD1,2 | Yang Yang DDS, MSc1,2| Yufeng Zhang DDS, PhD1,2 | Ричард Дж. Мирон DDS, PhD3
- The State Key Laboratory Breeding Base of Basic Science Of Stomatology (Hubei-MOST) & Key Laboratory of Oral Biomedicine Ministry of Education, School & Hospital of Stomatology, Wuhan University (Ухань, Китай).
- Department of Oral Implantology, School and Hospital of Stomatology, Wuhan University (Ухань, Китай)
- Department of Periodontology, University of Bern (Берн, Швейцарія)
PRP і PRF: історія, факти, порівняння
Регенеративна медицина та омолоджувальна терапія стали чи не найперспективнішими напрямами естетичної медицини, завдяки новітнім дослідженням та досягненням останнього десятиріччя.
У той час, коли перші версії тромбоцитарних концентратів отримували з використанням антикоагулянтів (PRP), нещодавні дослідження з модифікацією швидкості та часу центрифугування, дозволили виробити рідку фракцію збагаченого тромбоцитами фібрину (PRF), і що найголовніше - без використання антикоагулянтів.
Метою створення даного продукту було порівняння повністю натурального концентрату тромбоцитів (PRF) з уже відомим PRP, з огляду на процес регенерації клітин шкіри.
З цією метою, фібробласти шкіри культивували з використанням PRF або PRP, та досліджували їхню здатність сприяти і впливати на життєздатність, міграцію, проліферацію клітин та рівень мРНК медіаторів біологічних процесів у шкірі, включаючи вивільнення PDGF, TGF - бета, фібронектину.
Результати показали, що усі концентрати тромбоцитів були нетоксичними для клітин, що демонструвало їхній високий рівень виживання.
В результаті, обидві фракції тромбоцитів (PRP та PRF) не виявили жодної токсичності. Однак, міграція фібробластів шкіри (більш ніж на 350%) була більшою під час застосування PRF, порівняно з контрольною фракцією PRP (збільшення на 200%). Індукція клітинної проліферації через 5 днів була більшою під час використання PRF.
Відомо, що і PRP, і PRF стимулювали підвищення рівня синтезу мРНК фактору PDGF. Однак було виявлено, що всі рівні TGF - бета, колагену 1 типу та фібронектину мРНК були значно вищими у групі з використанням PRF.
Окрім цього, PRF продемонстрував значно більшу здатність індукувати синтез матричного колагену у порівнянні із властивостями PRP.
Згідно з результатами дослідження, PRF демонструє більший регенераційний потенціал впливу на фібробласти шкіри людини.
Клінічні дослідження в естетиці омолодження обличчя із використанням PRF - тромбоцитарних концентратів без антикоагулянтів, доводять потенційні переваги над PRP.
Фібрин, збагачений тромбоцитами (PRF) – сильніший стимулятор міграції фібробластів, їх проліферації, синтезу колагену в порівнянні з PRP.
Старіння шкіри: механізми, сучасний підхід до омолодження
Старіння шкіри – це неминучий процес, який відбувається з плином часу.
Він характеризується зниженням регенеративної здатності клітин, що так само призводить до втрати тканинної маси (описано в літературі як резорбція).2
З віком, загальна кількість колагену та еластину в шкірі теж зменшується, водночас відбувається їхня якісна деградація.
Ці процеси призводять до тривимірних змін форми та контурів обличчя: втрати тонусу шкіри, появи зморщок, заломів. Сюди відносять і зміни текстури шкіри, її сухість та ксероз.
Зважаючи на постійно зростаючий попит на омолоджувальну естетику обличчя, регенерація тканин у процесі старіння, залишатиметься пріоритетом, тим паче, що постійно розвиваються нові технології та засоби корекції процесів старіння.
Однією з таких технологій є аутологічна мезотерапія плазмою крові.
Збагачена тромбоцитами плазма (PRP), регулярно використовується протягом останніх двох десятиліть, як ефективне доповнення до різноманітних медичних процедур, зокрема регенеративних.
PRP широко застосовується завдяки своїй здатності активізовувати цитокіни та фактори росту. Своїх властивостей плазма набуває в результаті центрифугування з високими G (обертовими силами) і, як правило, з використанням антикоагулянтів.
PRP-технологія успішно застосовується в багатьох галузях медицини.
Галузі застосування PRP-терапії:
- лікування ран;
- травми м’яких тканин;
- щелепно-лицева хірургія;
- оральна та пародонтологічна хірургія;
- ортопедія;
- шлунково-кишкова хірургія;
- комбустіологія;
- естетична та регенеративна медицина.
Протягом останніх років, PRP використовується у лікувальних протоколах широкого спектру дерматологічних проблем, включаючи комплексну терапію рубців, акне, постакне, загоєння ран на обличчі, для пролонгування результатів ліпофілінгу, алопецію, покращення якості шкіри та її омолодження. 6,8
З α-гранул тромбоцитів, після їх активації індукторами агрегації, виділяється велика кількість факторів росту, включаючи TGF, PDGF, VEGF, IGF -1, EGF і FGF.
Багато з них впливають на фібробласти, стимулюючи процес синтезу колагену.
Незважаючи на численні показання для використання, та переваги самої технології PRP, невирішеним є питання щодо антикоагулянтів. Оскільки антикоагулянти під час додавання в плазму, пригнічують її регенеративні властивості.11,12
Що таке PRF?
Фібрин, збагачений тромбоцитами (PRF) - це концентрат, що складається з власне тромбоцитів плазми крові та факторів росту. Особливістю та унікальністю технології є те, що для отримання PRF антикоагулянти не застосовуються.13, 14
PRF отримують спрощеним методом, і він проходить лише один цикл центрифугування.
PRF, під час введення в тканини, утворює фібринову сітку, яка містить у своїй структурі численні фактори росту. Завдяки цьому під час процесу регенерації тканин, наявні в PRF фактори росту та цитокіни, вивільняються не одразу, а поступово, забезпечуючи пролонговану, правильну регенерацію тканин.13, 14
Таким чином, PRF не тільки підтримує гемостаз та фізіологічний процес загоєння ран, а й сприяє його пришвидшенню.
За останнє десятиліття, PRF набув широкого застосування, у стоматологічних та інших медичних процедурах.15
В естетичній медицині, PRF використовується для лікування дефектів м’яких тканин і травм обличчя, глибоких носогубних складок, поверхневих зморщок, у поєднанні з хірургічними процедурами, ліпофілінгом, у терапії рубців, акне, постакне.15
Процедура з PRF включає більш швидкий процес ангіонеогенезу – реваскуляризацію ураженої зони, швидше загоєння ран та повну імунну біосумісність.15
Різниця між PRP і PRF
Однією з проблем у застосуванні PRF, на відміну від PRP, було те, що PRF має в’язку консистенцію.
Постало питання отримання рідкого за консистенцією PRF, який міститиме фібриноген і тромбін до перетворення його у твердий фібрин.13
Флюїд-PRF залишається рідким протягом 15 хвилин, при цьому антикоагулянти не використовуються.
Завдяки вказаній властивості, його можна застосовувати як ін’єкційний матеріал.
А після ін’єкції у шкіру, він швидко згортається з утворенням фібрину.
Ці характеристики роблять PRP ідеальним для цілої низки медичних цілей, наприклад, у сфері естетики обличчя, де він застосовується для реваскуляризації тканин, як мінімально інвазивний, біосумісний, 100% натуральний ін’єкційний матеріал.
Метою доклінічного дослідження було виявлення регенераційного потенціалу PRF у порівнянні зі стандартним PRP.
Оцінювалась здатність фібробластів шкіри людини до проліферації, сприяння міграції клітин, рівень клітинної мРНК відомих медіаторів та синтез колагену in vitro.
2. МАТЕРІАЛИ ТА МЕТОДИ
2.1 Приготування PRP та флюїду-PRF
PRP отримали традиційним способом із застосуванням коагулянтів.16
Спершу PRP та бідну на тромбоцити плазму (PPP) відокремлювали від фракції еритроцитів (RBC) шляхом центрифугування, 10 мл цільної крові з антикоагулянтом (EDTA) при 900 g протягом 5 хв., а потім PRP відділяли від PPP шляхом центрифугування вдруге, при 2000 g протягом 15 хвилин. Врешті, було зібрано приблизно 1 мл PRP.
PRF отримували з використанням 10 мл цільної крові без антикоагулянта, і центрифугування проводили при 60 g протягом 3 хвилин. Верхній шар, що складався приблизно з 1 мл плазми, був позначений як флюїд-PRF. Потім ми перенесли PRP та флюїд-PRF у посуд із шести лунок і додали 5 мл DMEM/ HyClone/Thermo Fisher Scientific Inc.
2.2 Виділення шкірних фібробластів людини
У трьох донорів, які проходили відновлювальне лікування з приводу «заячої губи» взяли зразки шкіри обличчя.
Клітини фібробластів отримували з шкіри над верхньою губою. Зібрані зразки тричі промивали фосфатно - сольовим розчином (PBS; 150 мМ NaCl, 20 мМ фосфату натрію, рН 7,2), що містив 1% антибіотиків (100 ОД/мл пеніциліну G, 100 мкг/мл стрептоміцину, HyClone) та фракціонувався на невеликі шматки за допомогою стерильних хірургічних ножиць. Потім шматки шкірної тканини, в колбах для культивування T25 з DMEM, що містили 20% фетальної бичачої сироватки (FBS; Gibco, Life Technologies Corporation) з 1% антибіотиків помістили в інкубатор при 37 ° C при 5% CO2.
На 7-й день виявлено нові клітини навколо шматків шкіри. Після злиття новоутворених клітин, фібробласти шкіри трипсинізували і далі культивували в DMEM з 10% FBS.
2.3 Життєздатність клітин
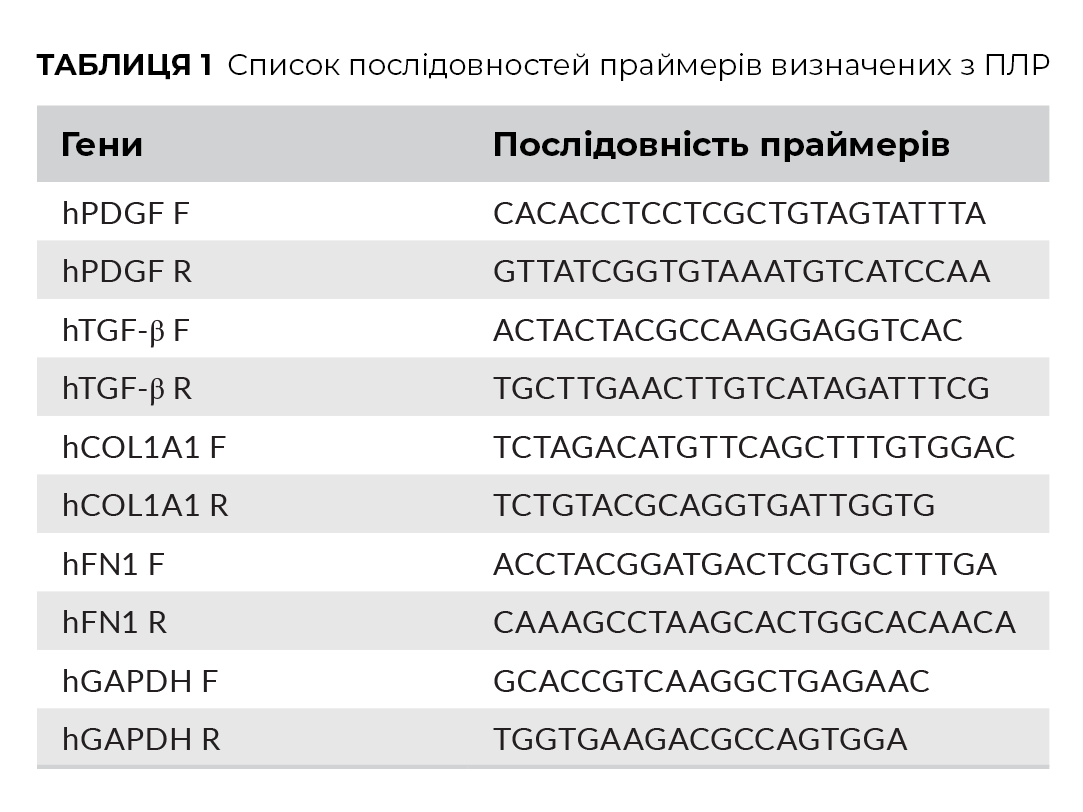
Через 24 години після посіву, клітини фібробластів шкіри людини були забарвлені 2 мкмоль/л мембранопроникним барвником – кальцеїном АМ (Доджіндо) та 4 мкмоль/л пропідію йодиду (ПІ, Сигма) протягом 15 хвилин при 37 ° С. Живі клітини фарбували зеленим з кальцеїном АМ, а мертві клітини - червоним з PI. Флуоресцентні зображення були зроблені за допомогою люмінесцентного мікроскопа Olympus DP71 (Olympus Co.). Після цього вираховувався відсоток клітин живих проти мертвих з PRP та PRF.
2.4 Клітинна морфологія
Для вивчення морфології клітин фібробласти шкіри людини висівали щільністю 10 000 клітин з/без додавання PRP або флюїду-PRF (концентрація 20%) у 24-лункові планшети. Через 2, 4, 8 та 24 години клітини фіксували 4% формальдегідом з наступним промиванням PBS протягом 5 хвилин. Потім клітини фарбували 5 мкг/мл фалоїдином-FITC (зелена флуоресценція, Sigma-Aldrich) протягом 1 години у темряві при 37°C. 16 Ядра фарбували DAPI (синя флуоресценція).
Флуоресцентні зображення зроблено за допомогою флуоресцентного мікроскопа Olympus DP 71 (Olympus Co) та порівняли їх за морфологічними відмінностями.
Аналіз клітини проводили за допомогою програми ImageJ.
Експеримент проводили трикратно під час трьох незалежних досліджень.
ПЛР - аналіз у режимі реального часу
Для дослідження експресії генів, пов'язаних з регенерацією, були визначені тромбоцитарний фактор росту (PDGF), трансформуючий фактор росту - бета (TGF -β), колаген 1 типу alpha1 (COL1a1) та фібронектин (FN1). Аналіз проводився методом ПЛР у реальному часі.
Фібробласти шкіри людини культивували з/без PRP або флюїд - PRF (концентрація 20%) у 24 - лунковому планшеті зі щільністю 50000 клітин на лунку. Через 3 та 7 днів культивування загальна РНК була екстрагована з клітин за допомогою AxyPrepTM Multisource Total RNA Miniprep Kit (AXYGEN) згідно протоколу виробника. Концентрацію РНК визначали за допомогою спектрофотометра NanoDrop 2000 UV-Vis.
Фарбування колагену I типу
Фібробласти людської шкіри культивували на 24-лунковому планшеті зі щільністю 50000 клітин на лунку протягом 7 днів. Клітини промивали PBS і фіксували 4% формальдегідом протягом 10 хвилин. Потім їх інкубували протягом 1 години до колагену 1 типу (1: 100, Boster Biological Technology Ltd), розведеного у PBS, що містив 2% бичачого сироваткового альбуміну (BSA) з подальшою інкубацією з козячим антибіотиком FITC. (1: 200, Invitrogen).
Врешті, ядра фарбували за допомогою DAPI (синя флуоресценція). Після кожного етапу, клітини тричі промивали PBS.
Зображення були зроблені за допомогою флуоресцентного мікроскопа Olympus DP71 (Olympus Co.). Кількісний аналіз інтенсивності фарбування проводили за допомогою програмного забезпечення ImageJ.
Статистичний аналіз
Статистичний аналіз проводили за допомогою односторонньої ANOVA з тестом Бонферроні за допомогою програмного забезпечення GraphPad v. 6, і статистична значимість розглядалася при Р <0,05. Усі дані виражені як середнє значення ± SE.
3. РЕЗУЛЬТАТИ
3.1 Життєздатність клітин
Під час вивчення впливу PRF та PRP на життєздатність клітин шкіри встановлено, що через 24 години > 95% клітин залишилося життєздатними, при цьому не спостерігалося значних відмінностей між групами. І PRP, і PRF не виявляли токсичності щодо виживання клітин.
3.2 Міграція клітин
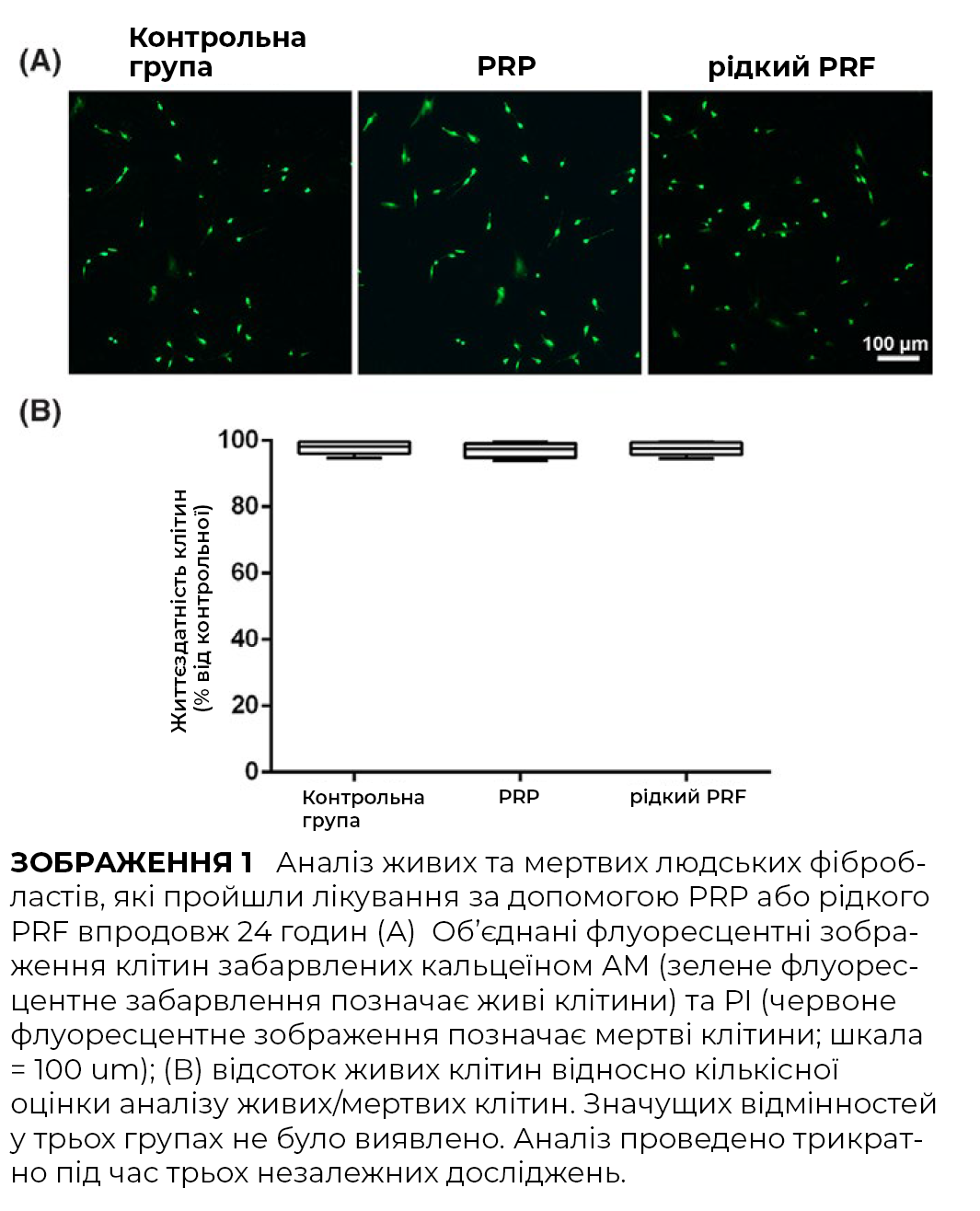
Оскільки кількість і міграція фібробластів шкіри людини відіграють важливу роль протягом ранньої фази загоєння ран, вплив PRF та PRP досліджували за допомогою аналізу трансвелл. І PRP, і PRF стимулювали міграцію фібробластів шкіри людини через 24 години. Стимуляція міграції клітин PRP була на 200% більшою у порівнянні з контрольною групою, тоді як показники PRF становили на 300% збільшення міграції порівняно з контрольною групою.
3.3 Клітинна морфологія та проліферація
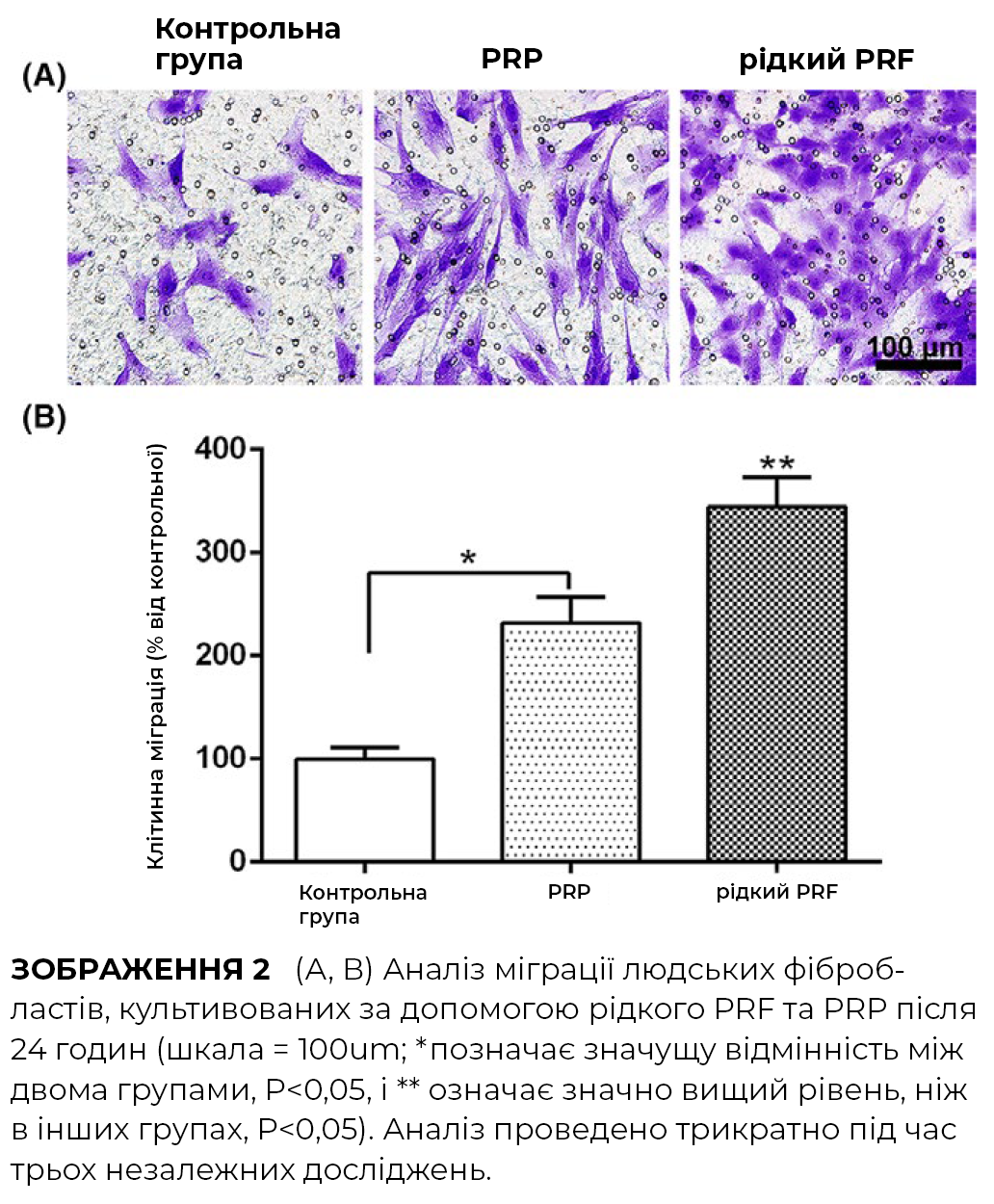
Фібробласти людської шкіри досліджували на морфологічні відмінності з/без застосування PRP та PRF через 2, 4, 8 та 24 години після посіву.
І PRP, і PRF значно збільшують клітинну проліферацію фібробластів шкіри людини на 3 та 5 день після посіву. Однак PRF далі продемонстрував значно більшу проліферацію клітин через 5 днів.
3.4 Експресія генів, пов'язаних з регенерацією фібробластів шкіри людини та ECM
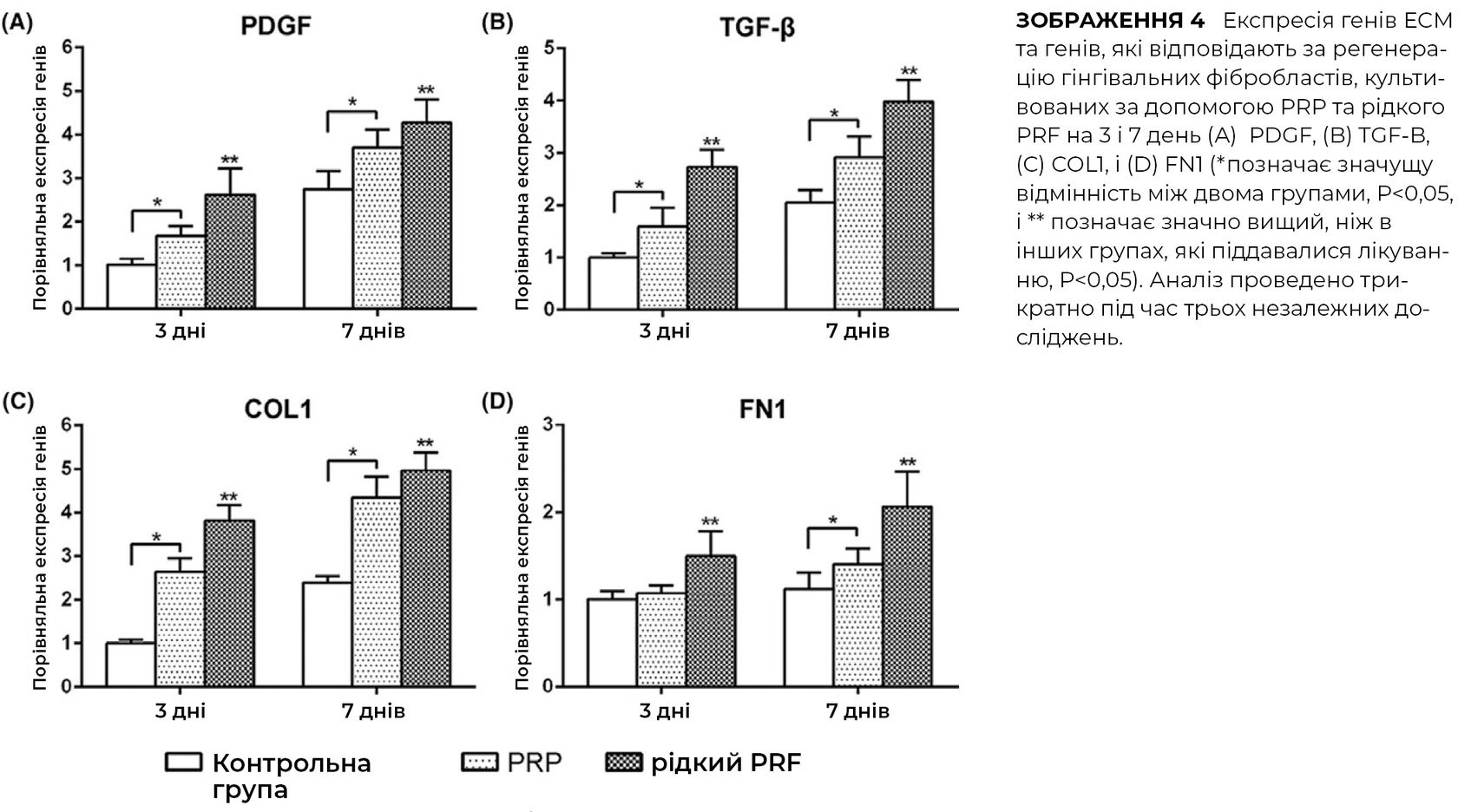
Вплив PRP та PRF на експресію генів, пов’язаних з регенерацією, включаючи фактори росту TGF-β та PDGF, оцінювали за допомогою ПЛР у реальному часі.
І PRP, і PRF індукували збільшення експресії PDGF та TGF-β на 3 та 7 день, при цьому PRF демонстрував значно вищі рівні мРНК PDGF через 3 дні та рівень мРНК TGF-β на 3 та 7 день після посіву. PRF значно підвищив рівень мРНК COL1 на 3 та 7 день. І PRP, і PRF значною мірою індукували експресію мРНК FN1, при цьому PRF продемонстрував значно вищі показники порівняно з усіма іншими групами.
3.5 Фарбування колагену I типу
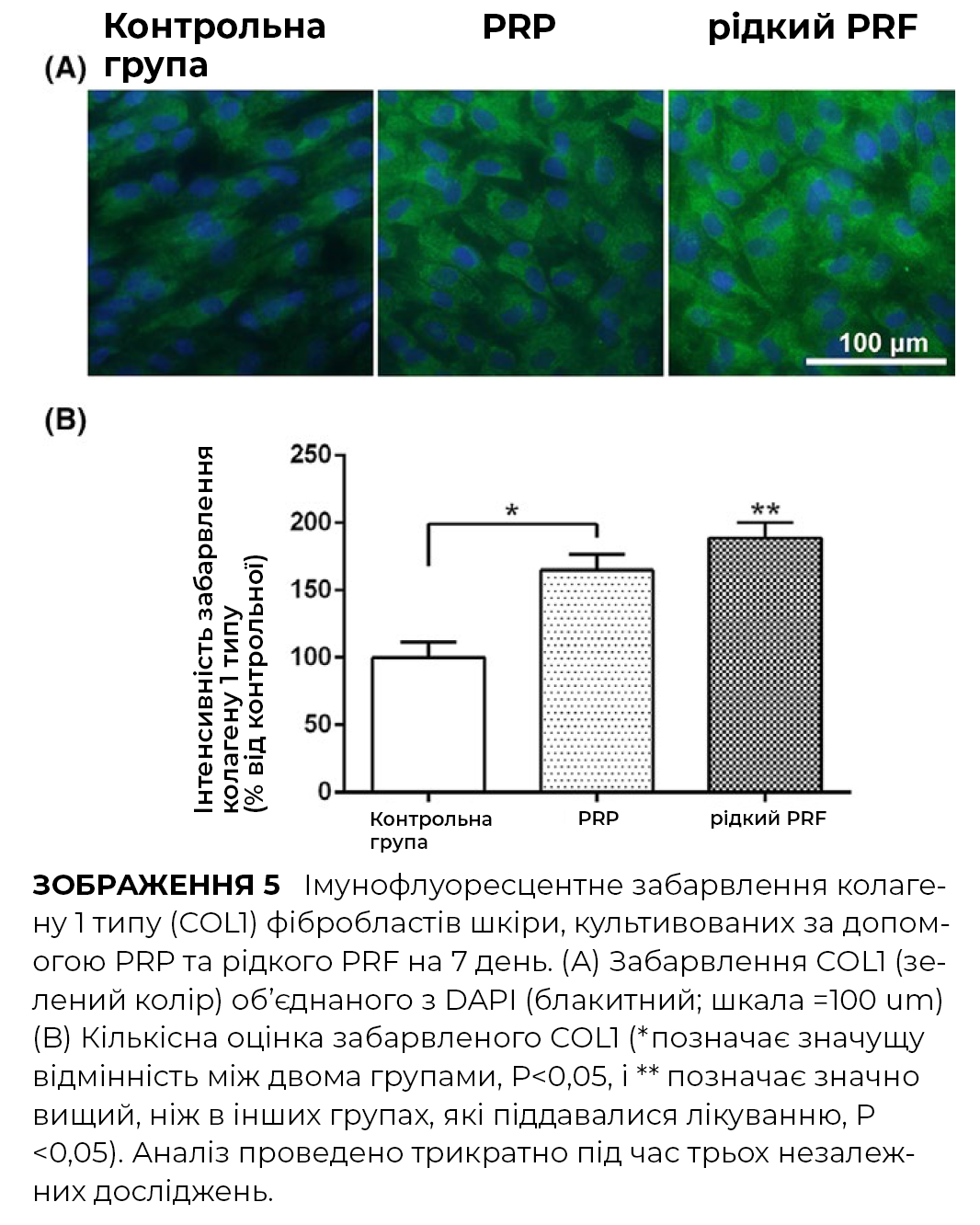
Для оцінки впливу PRP та PRF на синтез колагену фібробластами шкіри людини, було проведено імунофлуоресцентне фарбування колагену 1 типу. PRP показав незначне збільшення внутрішньоклітинного фарбування колагену типу 1, тоді як PRF індукував приблизно двократне збільшення колагену типу 1 серед трьох груп.
4. ОБГОВОРЕННЯ
У цьому експерименті, регенеративний потенціал PRF досліджували щодо активності фібробластів шкіри, порівняно зі стандартним PRP. Поки що це перше регенеративне дослідження, що вивчає застосування PRF у сфері естетики обличчя в доклінічній моделі та клінічних умовах.
Метою було спочатку перевірити, а потім охарактеризувати регенеративний потенціал PRF in vitro, на шкірних фібробластах шкіри порівняноз PRP.
Однією з основних переваг використання PRF у різних галузях регенеративної медицини, є її низька вартість у порівнянні з іншими регенеративними методами, чи рекомбінантними факторами росту/гормонами.15 Оскільки забір крові проводиться без використання антикоагулянтів, терапія PRF є повністю біосумісною, передбачає утворення аутологічного фібринового згустку за допомогою центрифугування.
Центрифугування здійснювали протягом 12 хвилин при 2700 об/хв (сила приблизно 700g при RCF-max).18 Центрифугування на більшій швидкості призводять до цілковитої втрати лейкоцитів та інших факторів росту.19
У зв’язку з цим, нещодавно було запропоновано використовувати менші швидкості центрифугування для збільшення кількості лейкоцитів та факторів росту, що містяться в PRF.19, 20 Під час цього дослідження виявлено, що PRF з фібриногеном і тромбіном PRF можна отримати у рідкій формі ще до утворення фібринового згустку. Вказану, рідку фракцію PRF можна використовувати приблизно протягом 15 хвилин. Завдяки цьому, його застосовують, як ін’єкційний препарат у різних галузях медицини, наприклад, у стоматології, зокрема у поєднанні з різними біоматеріалами, в ортопедичних ін’єкціях при остеоартриті коліна, а зовсім недавно і в естетиці обличчя.
Це дослідження продемонструвало вплив PRP або PRF на поведінку фібробластів шкіри в культурі клітин шкіри.
Виявлено, що PRF має здатність значно збільшувати міграцію фібробластів порівняно з PRP.
У клінічному контексті це означає, що застосування в естетиці обличчя методики PRF, забезпечує утворення більшої кількості нових клітин та високі рівні їх проліферації у порівнянні із застосуванням PRP.
Під час порівняння кількості мРНК факторів росту та білків позаклітинного матриксу, за допомогою ПЛР виявлено, що PRF підвищує рівень мРНК асоційованих генів. Також, цікавим є той факт, що PRF містить більш високі рівні факторів росту порівняно з PRP.
Дослідження показало, що менші швидкості центрифугування дають більшу кількість лейкоцитів у PRF. 13, 14; Проте, специфічна роль лейкоцитів, під час регенерації тканин та відновлення ран, поки не повністю зрозуміла. Цікаво, що перевагою лейкоцитів є те, що вони являються імунними клітинами, відповідальними за захист господаря, і стійкість до патогенів під час процесу загоєння.
Вони також виділяють широкий спектр факторів росту, пов'язаних з регенерацією тканин.22
І найголовніше: три окремі дослідження трьох незалежних груп нещодавно показали, що під час додавання лейкоцитів до стандартних препаратів PRP (PRP зазвичай містить низькі концентрації лейкоцитів), загоєння ран було значно кращим. 23, 25
Тож, незважаючи на те, що їхня роль залишається дещо незрозумілою, дослідження демонструють, що лейкоцити відіграють надзвичайно важливу роль під час загоєння ран.
Хоча це дослідження залишається доклінічним, дані показують, що PRF підтримує міграцію та проліферацію фібробластів шкіри, збільшує рівень клітинної мРНК потужних регенеративних факторів росту та молекул позаклітинного матриксу, а також покращує синтез колагену.
Список літератури:
- Zhou, Y.; Fu, B.; Zheng, X.; Wang, D.; Zhao, C.; Qi, Y.; Sun, R.; Tian, Z.; Xu, X.; Wei, H. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients. Natl. Sci. Rev. 2020, 7, 998–1002. [CrossRef]
- Xu, Y.; Baylink, D.J.; Chen, C.S.; Reeves, M.E.; Xiao, J.; Lacy, C.; Lau, E.; Cao, H. The importance of vitamin d metabolism as a potential prophylactic, immunoregulatory and neuroprotective treatment for COVID-19. J. Transl. Med. 2020, 18, 322. [CrossRef] [PubMed]
- Ali, A.M.; Kunugi, H. Approaches to nutritional screening in patients with Coronavirus Disease 2019 (COVID-19). Int. J. Environ. Res. Public Health 2021, 18, 2772. [CrossRef] [PubMed]
- Wang, W.; Xu, Y.; Gao, R.; Lu, R.; Han, K.; Wu, G.; Tan, W. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA 2020, 323, 1843–1844. [CrossRef]
- Tavazzi, G.; Pellegrini, C.; Maurelli, M.; Belliato, M.; Sciutti, F.; Bottazzi, A.; Sepe, P.A.; Resasco, T.; Camporotondo, R.; Bruno, R.; et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur. J. Heart Fail. 2020, 22, 911–915. [CrossRef]
- Riuzzi, F.; Sorci, G.; Sagheddu, R.; Chiappalupi, S.; Salvadori, L.; Donato, R. RAGE in the pathophysiology of skeletal muscle. J. Cachexia Sarcopenia Muscle 2018, 9, 1213–1234. [CrossRef]
- Egawa, T.; Ohno, Y.; Yokoyama, S.; Yokokawa, T.; Tsuda, S.; Goto, K.; Hayashi, T. The Protective Effect of Brazilian Propolis against Glycation Stress in Mouse Skeletal Muscle. Foods 2019, 8, 439. [CrossRef]
- Nasiri, M.J.; Haddadi, S.; Tahvildari, A.; Farsi, Y.; Arbabi, M.; Hasanzadeh, S.; Jamshidi, P.; Murthi, M.; Mirsaeidi, M. COVID-19 clinical characteristics, and sex-specific risk of mortality: Systematic Review and Meta-analysis. Front. Med. 2020, 7, 459. [CrossRef]
- Zhu, J.; Ji, P.; Pang, J.; Zhong, Z.; Li, H.; He, C.; Zhang, J.; Zhao, C. Clinical characteristics of 3062 COVID-19 patients: A meta-analysis. J. Med. Virol. 2020. [CrossRef]
- Vacchiano, V.; Riguzzi, P.; Volpi, L.; Tappatà, M.; Avoni, P.; Rizzo, G.; Guerra, L.; Zaccaroni, S.; Cortelli, P.; Michelucci, R.; et al. Early neurological manifestations of hospitalized COVID-19 patients. Neurol. Sci. 2020, 41, 2029–2031. [CrossRef]
- Nidadavolu, L.; Walston, J. Underlying Vulnerabilities to the Cytokine Storm and Adverse COVID-19 Outcomes in the Aging Immune System. J. Gerontol. A Biol. Sci. Med. Sci. 2020. [CrossRef]
- Paliwal, V.K.; Garg, R.K.; Gupta, A.; Tejan, N. Neuromuscular presentations in patients with COVID-19. Neurol. Sci. 2020, 41, 3039–3056. [CrossRef] [PubMed]
- Finsterer, J.; Scorza, F. SARS-CoV-2 associated rhabdomyolysis in 32 patients. Turk. J. Med. Sci. 2021. [CrossRef]
- Zhang, X.; Cai, H.; Hu, J.; Lian, J.; Gu, J.; Zhang, S.; Ye, C.; Lu, Y.; Jin, C.; Yu, G.; et al. Epidemiological, clinical characteristics of cases of SARS-CoV-2 infection with abnormal imaging findings. Int. J. Infect. Dis. 2020, 94, 81–87. [CrossRef]
- Welch, C.; Greig, C.; Masud, T.; Wilson, D.; Jackson, T.A. COVID-19 and Acute Sarcopenia. Aging Dis. 2020, 11, 1345–1351.[CrossRef]
- Pitscheider, L.; Karolyi, M.; Burkert, F.R.; Helbok, R.; Wanschitz, J.V.; Horlings, C.; Pawelka, E.; Omid, S.; Traugott, M.;Seitz, T.; et al. Muscle involvement in SARS-CoV-2 infection. Eur. J. Neurol. 2020. [CrossRef]
- Jin, M.; Tong, Q. Rhabdomyolysis as Potential Late Complication Associated with COVID-19. Emerg. Infect. Dis. 2020, 26, 1618–1620. [CrossRef]
- Breucker, S.D.; Luce, S.; Njemini, R.; Bautmans, I.; Decoster, L.; Mets, T.; Pepersack, T. Analysis of inflammatory markers and hormones in old cancer patients: A descriptive study. Exp. Gerontol. 2020, 130. [CrossRef]
- Zhou, L.; Liu, C.; Yang, C. Comment on ‘COVID-19: A major cause of cachexia and sarcopenia’ by Morley et al. J. Cachexia Sarcopenia Muscle 2021, 12, 233–234. [CrossRef]
- Rosato, C.; Bolondi, G.; Russo, E.; Oliva, A.; Scognamiglio, G.; Mambelli, E.; Longoni, M.; Rossi, G.; Agnoletti, V. Clinical, electromyographical, histopathological characteristics of COVID-19 related rhabdomyolysis. SAGE Open Med. Case Rep. 2020, 25, 2050313X20983132. [CrossRef]
- Zhan, T.; Liu, M.; Tang, Y.; Han, Z.; Cheng, X.; Deng, J.; Chen, X.; Tian, X.; Huang, X. Retrospective analysis of clinical characteristics of 405 patients with COVID-19. J. Int. Med. Res. 2020, 48, 300060520949039. [CrossRef]
- Cheng, A.; Hu, L.; Wang, Y.; Huang, L.; Zhao, L.; Zhang, C.; Liu, X.; Xu, R.; Liu, F.; Li, J.; et al. Diagnostic performance of initial blood urea nitrogen combined with D-dimer levels for predicting in-hospital mortality in COVID-19 patients. Int. J. Antimicrob. Agents 2020, 56, 106110. [CrossRef]
- Liu, G.; Zhang, S.; Mao, Z.; Wang, W.; Hu, H. Clinical significance of nutritional risk screening for older adult patients with COVID-19. Eur. J. Clin. Nutr. 2020, 74, 876–883. [CrossRef]
- Garrigues, E.; Janvier, P.; Kherabi, Y.; Le Bot, A.; Hamon, A.; Gouze, H.; Doucet, L.; Berkani, S.; Oliosi, E.; Mallart, E.; et al. Post-discharge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J. Infect. 2020, 81, e4–e6. [CrossRef]
- Zhong, H.; Wang, Y.; Zhang, Z.L.; Liu, Y.X.; Le, K.J.; Cui, M.; Yu, Y.T.; Gu, Z.C.; Gao, Y.; Lin, H.W. Efficacy and safety of current therapeutic options for COVID-19—Lessons to be learnt from SARS and MERS epidemic: A systematic review and meta-analysis. Pharmacol. Res. 2020, 157, 104872. [CrossRef]
- Du, X.; Liu, Y.; Chen, J.; Peng, L.; Jin, Y.; Cheng, Z.; Wang, H.H.X.; Luo, M.; Chen, L.; Zhao, Y. Comparison of the Clinical Implications among Two Different Nutritional Indices in Hospitalized Patients with COVID-19. medRxiv 2020. [CrossRef]
- Haraj, N.E.; El Aziz, S.; Chadli, A.; Dafir, A.; Mjabber, A.; Aissaoui, O.; Barrou, L.; El Kettani El Hamidi, C.; Nsiri, A.; Al
- Di Filippo, L.; De Lorenzo, R.; D’Amico, M.; Sofia, V.; Roveri, L.; Mele, R.; Saibene, A.; Rovere-Querini, P.; Conte, C. COVID-19 is associated with clinically significant weight loss and risk of malnutrition, independent of hospitalisation: A post-hoc analysis of a prospective cohort study. Clin. Nutr. 2020. [CrossRef]
- Gualtieri, P.; Falcone, C.; Romano, L.; Macheda, S.; Correale, P.; Arciello, P.; Polimeni, N.; Lorenzo, A. Body Composition Findings by Computed Tomography in SARS-CoV-2 Patients: Increased Risk of Muscle Wasting in Obesity. Int. J. Mol. Sci. 2020, 21, 4670. [CrossRef]
- Zeppa, S.D.; Agostini, D.; Piccoli, G.; Stocchi, V.; Sestili, P. Gut Microbiota Status in COVID-19: An Unrecognized Player? Front. Cell Infect. Microbiol. 2020. [CrossRef]
- Zhao, X.; Li, Y.; Ge, Y.; Shi, Y.; Lv, P.; Zhang, J.; Fu, G.; Zhou, Y.; Jiang, K.; Lin, N.; et al. Evaluation of Nutrition Risk and Its Association with Mortality Risk in Severely and Critically Ill COVID-19 Patients. J. Parenter. Enter. Nutr. 2020, 45, 32–42. [CrossRef] [PubMed]
- Witteveen, E.; Wieske, L.; van der Poll, T.; van der Schaaf, M.; van Schaik, I.N.; Schultz, M.J.; Verhamme, C.; Horn, J. Increased Early Systemic Inflammation in ICU-Acquired Weakness; A Prospective Observational Cohort Study. Crit. Care Med. 2017, 45, 972–979. [CrossRef] [PubMed]
- De Lorenzo, R.; Conte, C.; Lanzani, C.; Benedetti, F.; Roveri, L.; Mazza, M.G.; Brioni, E.; Giacalone, G.; Canti, V.; Sofia, V.; et al. Residual clinical damage after COVID-19: A retrospective and prospective observational cohort study. PLoS ONE 2020, 15, e0239570. [CrossRef] [PubMed]
- Alrubaye, R.; Choudhury, H. Severe Rhabdomyolysis in a 35-Year-old Woman with COVID-19 due to SARS-CoV-2 Infection: A Case Report. Am. J. Case Rep. 2020, 21, e926733. [CrossRef]
- Mukherjee, A.; Ghosh, R.; Aftab, G. Rhabdomyolysis in a Patient with Coronavirus Disease 2019. Cureus 2020, 12, e8956. [CrossRef] [PubMed]
- Disser, N.P.; De Micheli, A.J.; Schonk, M.M.; Konnaris, M.A.; Piacentini, A.N.; Edon, D.L.; Toresdahl, B.G.; Rodeo, S.A.; Casey,E.K.; Mendias, C.L. Musculoskeletal Consequences of COVID-19. J. Bone Jt. Surg. Am. 2020, 102, 1197–1204. [CrossRef] [PubMed]
- Ufuk, F.; Demirci, M.; Sagtas, E.; Akbudak, I.H.; Ugurlu, E.; Sari, T. The prognostic value of pneumonia severity score and pectoralis muscle Area on chest CT in adult COVID-19 patients. Eur. J. Radiol. 2020, 131, 109271. [CrossRef]
- Paneroni, M.; Simonelli, C.; Saleri, M.; Bertacchini, L.; Venturelli, M.; Troosters, T.; Ambrosino, N.; Vitacca, M. Muscle Strength and Physical Performance in Patients Without Previous Disabilities Recovering From COVID-19 Pneumonia. Am. J. Phys. Med. Rehabil. 2021, 100, 105–109. [CrossRef]
- Raman, B.; Cassar, M.P.; Tunnicliffe, E.M.; Filippini, N.; Griffanti, L.; Alfaro-Almagro, F.; Okell, T.; Sheerin, F.; Xie, C.; Mah-mod, M.; et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exercise capacity, cognition, quality of life and mental health, post-hospital discharge. EClinicalMedicine 2021, 31, 100683. [CrossRef]
- Li, T.; Zhang, Y.; Gong, C.; Wang, J.; Liu, B.; Shi, L.; Duan, J. Prevalence of malnutrition and analysis of related factors in elderly patients with COVID-19 in Wuhan, China. Eur. J. Clin. Nutr. 2020, 74, 871–875. [CrossRef]
- Reiss, J.; Iglseder, B.; Kreutzer, M.; Weilbuchner, I.; Treschnitzer, W.; Kässmann, H.; Pirich, C.; Reiter, R. Case finding for sarcopenia in geriatric inpatients: Performance of bioimpedance analysis in comparison to dual X-ray absorptiometry. BMC Geriatr. 2016, 16, 52. [CrossRef]
- Tosato, M.; Marzetti, E.; Cesari, M.; Savera, G.; Miller, R.R.; Bernabei, R.; Landi, F.; Calvani, R. Measurement of muscle mass in sarcopenia: From imaging to biochemical markers. Aging Clin. Exp. Res. 2017, 29, 19–27. [CrossRef]
- He, Y.C.; Chen, F. Rhabdomyolysis as Potential Late Complication Associated with COVID-19. Emerg. Infect. Dis. 2020, 26, 2297–2298. [CrossRef]
- Li, J.-W.; Han, T.-W.; Woodward, M.; Anderson, C.S.; Zhou, H.; Chen, Y.-D.; Neal, B. The impact of 2019 novel coronavirus on heart injury: A Systematic review and Meta-analysis. Prog. Cardiovasc. Dis. 2020, 63, 518–524. [CrossRef]
- Bansal, A.; Kumar, A.; Patel, D.; Puri, R.; Kalra, A.; Kapadia, S.R.; Reed, G.W. Meta-analysis Comparing Outcomes in Patients with and Without Cardiac Injury and Coronavirus Disease 2019 (COVID 19). Am. J. Cardiol. 2020. [CrossRef]
- Wu, T.; Zuo, Z.; Kang, S.; Jiang, L.; Luo, X.; Xia, Z.; Liu, J.; Xiao, X.; Ye, M.; Deng, M. Multi-organ Dysfunction in Patients with COVID-19: A Systematic Review and Meta-analysis. Aging Dis. 2020, 11, 874–894. [CrossRef]
- Lau, H.M.; Lee, E.W.; Wong, C.N.; Ng, G.Y.; Jones, A.Y.; Hui, D.S. The impact of severe acute respiratory syndrome on the physical profile and quality of life. Arch. Phys. Med. Rehabil. 2005, 86, 1134–1140. [CrossRef]
- Gkekas, N.K.; Anagnostis, P.; Paraschou, V.; Stamiris, D.; Dellis, S.; Kenanidis, E.; Potoupnis, M.; Tsiridis, E.; Goulis, D.G. The effect of vitamin D plus protein supplementation on sarcopenia: A systematic review and meta-analysis of randomized controlled trials. Maturitas 2021, 145, 56–63. [CrossRef]
- Liao, C.D.; Chen, H.C.; Huang, S.W.; Liou, T.H. The Role of Muscle Mass Gain Following Protein Supplementation Plus Exercise Therapy in Older Adults with Sarcopenia and Frailty Risks: A Systematic Review and Meta-Regression Analysis of Randomized Trials. Nutrients 2019, 11, 1713. [CrossRef]
- Chapple, L.-a.S.; Fetterplace, K.; Asrani, V.; Burrell, A.; Cheng, A.C.; Collins, P.; Doola, R.e.; Ferrie, S.; Marshall, A.P.; Ridley, E.J. Nutrition management for critically and acutely unwell hospitalised patients with coronavirus disease 2019 (COVID-19) in Australia and New Zealand. Nutr. Diet. 2020, 77, 426–436. [CrossRef]
- Cawood, A.L.; Walters, E.R.; Smith, T.R.; Sipaul, R.H.; Stratton, R.J. A Review of Nutrition Support Guidelines for Individuals with or Recovering from COVID-19 in the Community. Nutrients 2020, 12, 3230. [CrossRef] [PubMed]
- Yao, Y.; Luo, Z.; Zhang, X. In silico evaluation of marine fish proteins as nutritional supplements for COVID-19 patients. Food Funct. 2020, 11, 5565–5572. [CrossRef] [PubMed]
- Cengiz,M.;BorkuUysal,B.;Ikitimur,H.;Ozcan,E.;Islamog ̆lu,M.S.;Aktepe,E.;Yavuzer,H.;Yavuzer,S.Effectoforall-Glutamine supplementation on Covid-19 treatment. Clin. Nutr. Exp. 2020, 33, 24–31. [CrossRef] [PubMed]
- Burgess, L.C.; Venugopalan, L.; Badger, J.; Street, T.; Alon, G.; Jarvis, J.C.; Wainwright, T.W.; Everington, T.; Taylor, P.; Swain, I.D. Effect of neuromuscular electrical stimulation on the recovery of people with COVID-19 admitted to the intensive care unit: A narrative review. J. Rehabil. Med. 2021. [CrossRef] [PubMed]
- Liu, K.; Zhang, W.; Yang, Y.; Zhang, J.; Li, Y.; Chend, Y. Respiratory rehabilitation in elderly patients with COVID-19: A randomized controlled study. Complement Ther. Clin. Pract. 2020, 39, 101166. [CrossRef]
- Chaabene, H.; Prieske, O.; Herz, M.; Moran, J.; Höhne, J.; Kliegl, R.; Ramirez-Campillo, R.; Behm, D.G.; Hortobágyi, T.; Granacher, U. Home-based exercise programmes improve physical fitness of healthy older adults: A PRISMA-compliant systematic review and meta-analysis with relevance for COVID-19. Ageing Res. Rev. 2021, 67, 101265. [CrossRef]
Totis Pharma
22.12.2021
7149





